1° S

1° S - T.P. de Chimie n° 10 :
OXYDATION MENAGEE DES ALCOOLS
Le but du TP est de comparer l’oxydation ménagée des alcools selon leur classe et les conditions
expérimentales.
I. Questions préliminaires
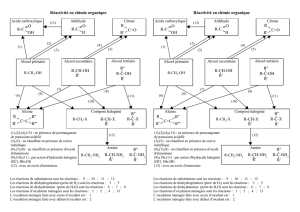
1. Rappeler quel est le groupe caractéristique des alcools.
2. Ecrire l’équation de la combustion complète d’un alcool de formule générale CnH2n+1 - OH. Pourquoi dit-on qu’il
s’agit d’une oxydation totale ?
3. Qu’est-ce qu’une oxydation ménagée ?
4. Ecrire les formules semi-développées du propan-1-ol, du propan-2-ol, du butan-1-ol et du butan-2-ol. Préciser,
pour les alcools isomères, le type d’isomérie mis en jeu.
5. Les alcools sont repartis en trois classes (primaire, secondaire ou tertiaire) selon le nombre d’atomes de
carbone liés à l’atome de carbone portant le groupe fonctionnel. En déduire la classe de chacun des quatre alcools
précédents.
II. Oxydation ménagée à chaud
1. Protocole expérimental
Dans un ballon de 250 mL, introduire avec précautions :
- V1 = 15 mL de la solution oxydante de permanganate de potassium C1 = 2,0. 10 -2 mol. L-1 acidifiée par de
l’acide sulfurique.
- V2 = 5,0 mL d’alcool primaire ou secondaire (selon les groupes).
Adapter le ballon au montage de distillation fractionnée puis, porter le mélange à ébullition douce et recueillir le
produit qui distille, dans un tube à essai, sur une hauteur de 2 cm environ. Noter la température constante
pendant que le produit est distillé et la couleur finale du mélange réactionnel.
2. Test d’identification du produit obtenu
Prendre 2 tubes à essai propres.
- Dans le tube n° 1, intoduire environ 0,5 mL de 2,4-dinitrophénylhydrazine (notée D.N.P.H. dans la suite), verser
quelques gouttes du distillat obtenu. Agiter le tube à essai.
- Dans le tube n° 2, introduire environ 1 mL de réactif de Fehling, verser le reste du distillat obtenu et agiter le
mélange obtenu. Placer le tube à essai dans un bain-marie contenant de l’eau chaude à environ 60 °C pendant
3 min.
Noter le résultat des tests.
3. Identification du produit obtenu
Compléter le tableau suivant à partir des résultats obtenus par l’ensemble des groupes et du tableau de données.
alcool
Test sur le produit formé
Produit obtenu
Classe
Nom
D.N.P.H.
Réactif de
Fehling
famille
Formule semi-
développée
nom
primaire
secondaire

4. Exploitation des résultats
Répondre aux questions suivantes, seulement pour l’alcool (propan-1-ol, propan-2-ol, butan-1-ol ou butan-2-ol) que
vous avez utilisé.
4.1. Quels sont les couples oxydant / réducteur mis en jeu ?
4.2. Ecrire l’équation de la réaction d’oxydation ménagée qui a eu lieu dans les conditions de l’expérience. Préciser
quel est l’oxydant, le réducteur.
4.3. Déterminer les quantités initiales d’ions permanganate et d’alcool qui ont été mises en présence dans le
ballon.
4.4. Etablir le tableau descriptif de l’état du système au cours de la transformation chimique réalisée.
4.5. Quel est le réactif limitant et la valeur de l’avancement final ? Est-ce cohérent avec la couleur finale du
mélange réactionnel ?
4.6. À partir résultats obtenus par l’ensemble des groupes, tirer une conclusion générale.
III. Oxydation ménagée à froid (expérience non réalisée en classe)
1. Protocole expérimental
Dans un erlenmeyer, on introduit :
- 20 mL d’eau distillée avec une éprouvette graduée ;
- 10 gouttes de butan-1-ol ou butan-2-ol, avec une pipette souple ;
- 20 gouttes d’acide sulfurique concentré (avec des gants et des lunettes) ;
- 15 mL d’une solution de permanganate de potassium environ 4,0. 10 -1 mol. L-1 avec une éprouvette graduée
(solution saturée). L’addition de cette solution se fait en plusieurs fois et avec précaution.
On ferme l’erlenmeyer avec un bouchon et on agite doucement à la main, le mélange pendant plusieurs minutes.
2. Caractérisation et identification du produit obtenu
La solution restant colorée, il faut extraire le produit d’oxydation avec de l’heptane ou du cyclohexane avant de
faire les tests de caractérisation. Les tests de caractérisation donnent les résultats suivants :
alcool
Test sur le produit formé
Produit obtenu
Classe
Nom
D.N.P.H.
réactif de
Fehling
famille
Formule semi-
développée
nom
primaire
-
-
secondaire
+
-
3. Exploitation des résultats
Répondre aux questions suivantes seulement pour un alcool (butan-1-ol ou butan-2-ol).
3.1. Quels sont les couples oxydant / réducteur mis en jeu ?
3.2. Ecrire l’équation de la réaction d’oxydation ménagée qui a eu lieu dans les conditions de l’expérience. Préciser
quel est l’oxydant, le réducteur.
3.3. Compte tenu de la couleur finale du mélange réactionnel, quel est le réactif limitant ?
3.4. À partir résultats obtenus par l’ensemble des groupes, tirer une conclusion générale.
IV. Synthèse générale
On précise que les alcools tertiaires sont inoxydables.
En généralisant les résultats obtenus au cours du TP et en tenant compte de la remarque précédente, faire un
tableau récapitulatif faisant apparaître les différences de réactivité en fonction de la classe de l’alcool et de la
quantité d’oxydant utilisé.

Données physico-chimiques :
composé
Masse volumique
(g. mL-1)
Température de
fusion (° C)
P = 1013 hPa
Température
d’ébullition (° C)
P = 1013 hPa
Propan-1-ol
0,80
- 127
97
Propan-2-ol
0,79
- 90
82
Butan-1-ol
0,81
- 90
117
Butan-2-ol
0,81
- 115
99
Propanal
0,81
- 80
48
Butanal
0,80
- 97
76
Propanone
0,79
- 95
56
Butanone
0,80
- 86
80
Acide butanoïque
0,96
- 8
163
Données physico-chimiques :
composé
Masse volumique
(g. mL-1)
Température de
fusion (° C)
P = 1013 hPa
Température
d’ébullition (° C)
P = 1013 hPa
Propan-1-ol
0,80
- 127
97
Propan-2-ol
0,79
- 90
82
Butan-1-ol
0,81
- 90
117
Butan-2-ol
0,81
- 115
99
Propanal
0,81
- 80
48
Butanal
0,80
- 97
76
Propanone
0,79
- 95
56
Butanone
0,80
- 86
80
Acide butanoïque
0,96
- 8
163
1
/
3
100%