defaut - Le Web Pedagogique

Auteur : Bruno Pin
Oxydation ménagée des alcools
Objectifs : Identifier la fonction organique du produit de l’oxydation ménagée d’un alcool,
l'oxydant utilisé étant soit en défaut, soit en excès.
Proposer un protocole expérimental pour déterminer la classe de l’alcool utilisé.
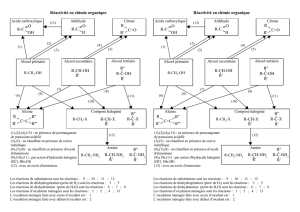
Définition d’une oxydation ménagée : contrairement à la combustion, une réaction
d’oxydation ménagée conserve le squelette carboné de la molécule. Une oxydation ménagée
est donc une oxydation douce tandis que la réaction de combustion est une oxydation brutale.
Les produits d’une combustion complète (oxydation brutale) d’un alcool sont le dioxyde de
carbone et l’eau. Ecrire l’équation de la réaction de combustion de l’éthanol.
Notion préliminaire : à l’état pur le permanganate de potassium est un solide ionique cristallisé
dont la formule statistique s’écrit KMnO4. Ce cristal est très soluble dans l'eau, l’équation de
réaction de dissolution du permanganate de potassium dans l’eau s’écrit
KMnO4
eau
K(aq)MnO4
(aq)
.
L’oxydant utilisé dans le protocole qui suit est l’ion permanganate MnO4- de couleur violette en
solution aqueuse. Les alcools utilisés sont le butan-1-ol, le butan-2-ol et le 2-méthylpropan-2-
ol. Indiquer leur formule semi-développée ainsi que leur classe.
On utilisera les tests de mise en évidence vus dans le TP précédent. Rappeler l’utilité de ces
tests ainsi que les résultats observés dans le cas du test à la DNPH et du test de la liqueur de
Fehling.
PORT DE LUNETTE OBLIGATOIRE
PREMIERE PARTIE
Les alcools réagissent-ils tous avec la solution aqueuse
de permanganate de potassium ?
Dans trois tubes à essais, introduire respectivement environ 2 mL de butan-1-ol, de butan-2-ol
et de 2-méthylpropan-2-ol. Ajouter dans chaque tube trois gouttes d’une solution d’acide
sulfurique puis dix gouttes d’une solution de permanganate de potassium de concentration
molaire 1.10-3 mol.L-1. Agiter le tube après chaque ajout de réactif.
Faire un schéma et noter les observations.
DEUXIEME PARTIE
Quels sont les produits formés au cours de la réaction d’oxydation ?
Oxydation d’un alcool, l’oxydant étant en défaut.
a- Dispositif expérimental : on utilise un montage à hydrodistillation. Le distillat sera

recueilli dans un bécher placé dans un cristallisoir contenant de l’eau et de la glace.
b- Expérience : dans le ballon introduire 15 mL de la solution oxydante de
permanganate de potassium de concentration molaire 1.10-1 mol.L-1 mesurée avec une
éprouvette graduée, 20 gouttes de solution d’acide sulfurique de concentration molaire
5 mol.L-1 et 5 mL de butan-1-ol ou de butan-2-ol. Porter le mélange à ébullition très douce
(thermostat 6-7). Cesser la distillation lorsque l’on a recueilli environ 10 mL de distillat.
Faire un schéma et noter les observations.
c- Caractérisation du produit d'oxydation obtenu : prendre 2 tubes à essais propres.
* Dans le tube n°1 contenant environ 1 mL de D.N.P.H., verser une dizaine de gouttes du
distillat obtenu. Agiter.
* Dans le tube n°2 contenant environ 1 mL de liqueur de Felhing, verser environ 1 mL du
distillat obtenu. Agiter. Placer le tube dans un bain-marie.
Faire un schéma et noter les observations.
IV- Exploitation
Vous disposez d’un alcool de classe inconnue. Proposer un mode opératoire pour déterminer la
classe de cet alcool.
V- Quelques vérifications quantitatives…
Écrire la demi-équation électronique de réduction des ions permanganates. Le couple d’oxydo-
réduction du manganèse est MnO4-/Mn2+
1- Écrire la demi-équation électronique de l’oxydation du butan-1-ol en tenant compte
des résultats de la partie expérimentale.
2- En déduire l’écriture de la réaction de l’oxydation ménagée du butan-1-ol par les ions
MnO4-.
3- Idem avec le butan-2-ol
4- Déterminer les quantités de matières en ion permanganate et en butan-1-ol qui ont
été mises en présence. Etablir le tableau descriptif (tableau d’avancement) du système au
cours de la transformation chimique réalisée et montrer que l’oxydant est bien en défaut.
Données : * dalcool/eau = 0,8
1
/
2
100%