Quoi de neuf dans le cancer gastrique - Chirurgie

SOMMAIRE
Sur quels arguments discuter un dossier en rcp ?
C. Ducerf
Quelle est la place des traitements non chirurgicaux dans une option curative?
R. Brunet
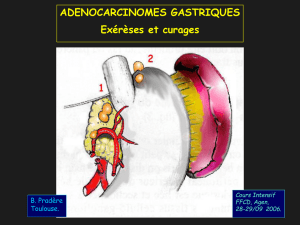
Le curage ganglionnaire : pourquoi, comment ?
G. Piessen
Quel type de gastrectomie et de rétablissement
D. Collet
Que faire en cas de découverte d’une carcinose péritonéale
S. Msika
La laparoscopie est-elle un standard en 2010?
J.L. bouillot

CANCER GASTRIQUE ET RCP
QUELLE PLACE POUR LE CHIRURGIEN ?
Christian DUCERF
Service de Chirurgie Digestive
Hôpital de la Croix-Rousse
LYON
La résection chirurgicale reste le seul traitement à visée curatrice de l’adénocarcinome invasif de
l’estomac. Il est donc capital une fois le diagnostic établi de se donner tous les moyens de savoir si le patient
pourra bénéficier de ce traitement. Les dossiers de tous les patients doivent faire l’objet d’une discussion
collégiale en particulier en préopératoire.
Le diagnostic est habituellement simple par l’endoscopie et les biopsies. Il faut savoir diagnostiquer un
lymphome gastrique dont le traitement sera spécifique et souvent non chirurgical. Le diagnostic est parfois
difficile pour des cancers prenant le masque de l’ulcère traité et cicatrisé par les IPP. Le diagnostic de lignite
gastrique peut être difficile et reste de mauvais pronostic. La répétition des examens endoscopiques et des
biopsies est parfois nécessaire.
L’état général du patient doit être soigneusement évalué par l’anesthésiste et le chirurgien.
L’évaluation du bénéfice risque de l’intervention chirurgicale doit être faite par l’équipe chirurgicale qui
soumettra cette évaluation au patient et à sa famille. La sanction d’inopérabilité ne doit pas être prise
uniquement en réunion sans évaluation clinique.
Le diagnostic du stade de la maladie doit être validé par tous. Le stade de la maladie va guider la
stratégie thérapeutique. La stadification est souvent simple avec des examens de base comme le TDM, l’IRM
voire l’écho-endoscopie. L’évaluation d’une carcinose péritonéale voire de micro-métastases hépatiques peut
nécessiter une exploration par cœlioscopie de la cavité abdominale soit dans le même temps opératoire, soit
mieux dans le cadre du bilan d’évaluation pour mieux programmer un éventuel traitement néo-adjuvant. Le
pet scanner, l’IRM de diffusion sont utiles, leur sensibilité et leur spécificité doivent être validées surtout avant
de contre indiquer un geste chirurgical.
Si, dans le meilleur des cas, un geste de résection chirurgicale peut être programmé, le choix de la
stratégie dans l’association thérapeutique avec la chimiothérapie (sels de platine, fluoropyrimidines,
anthracyclines, taxanes, irinotecan) et la radiothérapie ainsi que la chronologie utilisée seront discutés en RCP.
Il est très souhaitable d’inclure le patient dans un des nombreux protocoles d’évaluation thérapeutique soit
pré opératoire (de type MAGIC par exemple) soit post opératoire (tel qu’était le protocole Mac Donald) soit
pour évaluer le moment opportun des traitements complémentaires (protocoles TRACE ou PETACC7).
Les choix du chirurgien dans les options du protocole chirurgical (caractère total ou partiel de la
gastrectomie, étendue de la lymphadenectomie : D1 ou mieux D2-D3, choix de la reconstruction digestive)
doivent être argumentés par l’équipe chirurgicale en fonction des résultats du bilan préopératoire et
notamment d’une cartographie histologique la plus précise possible de la cavité gastrique. Des
recommandations de sociétés savantes (FFCD, SFCD) et de l’HAS existent dans ce domaine.

Une nouvelle RCP est nécessaire en post opératoire pour discuter du compte rendu de l’examen
anatomopathologique en présence du médecin pathologiste pour adapter une nouvelle stratégie en cas de
surprise per et post opératoire. Cette réunion est d’autant plus capitale qu’elle n’aurait pas eu lieu avant
l’intervention chirurgicale. Les données de l’examen anatomopathologique doivent être précises et complètes.
La qualité de l’examen de l’ensemble de la pièce opératoire, la recherche de dysplasies et métaplasies
éventuelles (Intestinal CDX2 + MUC2 + Gastrique MUC5AC + MUC 6 +) voie TP53, voie MSI (Instabilité Micro
satellitaire) caractère E-Cadhérine négatif et caractère diffus permettent de guider dans des voies
d’histogénèse complexes voire dans le pronostic. L’utilisation de classification (Lauren, Carneiro) permet de
préciser l’hétérogénéité des cancers gastriques. Le nombre de ganglions examinés est une donnée capitale.
Aujourd’hui, des examens d’immuno-histochimie à la recherche d’oncogènes et protéines spécifiques (anti-
HER2, anti-HER1, anti-VEGF, inhibiteurs voie C-met, inhibiteurs multityrosinekinase) peuvent guider le choix de
thérapeutiques ciblées (trastuzumab HERCEPTIN*, lapatinib, pour anti HER2 ; cetuximab, panitumumab, gefitib,
erlotinib pour anti HER1 et anti EGFR ; bevacizumab pour antiVEGF ; anti m-TOR et everolimus).
Le chirurgien garde une place très importante dans la prise en charge palliative d’un patient porteur
d’un cancer gastrique évolué en particulier métastatique. Il y a peu de place à la résection dans la prise en
charge chirurgicale des métastases hépatiques ou pulmonaires des cancers gastriques. La CHIP a montré une
certaine efficacité dans le traitement de certaines formes de carcinose péritonéale de cancer gastrique. C’est
surtout la discussion d’une éventuelle gastrectomie partielle palliative qualifiée à tord de propreté qui peut
être utile dans des formes sténosantes ou hémorragiques.

References
Benefit of adjuvant chemotherapy for resectable gastric cancer: a meta-analysis GASTRIC (Global
Advanced/Adjuvant StomachTumorResearchInternational Collaboration) Paoletti X, Oba K, Burzykowski
T,Michiels S, Ohashi Y, Pignon JP, Rougier P, Sakamoto J, Sargent D, Sasako M, Van Cutsem E, Buyse
M.Collaborators (45) Buyse M, Michiels S, Oba K, Paoletti X, Rougier P, Yamamoto S, Yoshimura K, Bang YJ,
Bleiberg H, Burzykowski T, Buyse M, Delbaldo C, Michiels S, Morita S, Ohashi Y, Paoletti X, Pignon JP, Pozzo C,
Rougier P, Sakamoto J, Sargent D, Sasako M, Van Cutsem E, Alberts S, Bajetta E, Benedetti J, Bonnetain F,
Bouche O, Coombes RC, Di Bartolomeo M, Grau JJ, Garcia-Valdecasas JC, Fuster J, Krook JE, Lordick F, Lise M,
Macdonald JS, Michel P, Nakajima T, Nashimoto A, Nelson GD, Nitti D, Popiela T, Rougier P, Tsavaris N. JAMA.
2010 May 5;303(17):1729 37.
Treatment Options for Surgically Resectable Gastric. Cancer.Curr Treat Options Oncol. 2010 Mar
27.Rajdev L.
Peritoneal Carcinomatosis from Gastric Cancer: A Multi-Institutional Study of 159 Patients Treated by
Cytoreductive Surgery Combined with Perioperative Intraperitoneal Chemotherapy. Ann Surg Oncol. 2010 Mar
25. Glehen O, Gilly FN, Arvieux C, Cotte E, Boutitie F, Mansvelt B, Bereder JM, Lorimier G, Quenet F, Elias D
Factors correlated with early and late recurrence after curative gastrectomy for gastric cancer.
Hepatogastroenterology. 2009 Nov-Dec;56(96):1760-4. Ogata K, Mochiki E, Yanai M, Toyomasu Y, Ando H,
Ohno T, Aihara R, Asao T, Kuwano H.

ADENOCARCINOMES GASTRIQUES
TRAITEMENTS NON CHIRURGICAUX
R. Brunet, R. Bodin
Bordeaux
Bien que son incidence ait sensiblement diminué au cours des 20 dernières années, le cancer gastrique
reste une préoccupation en cancérologie digestive tant son pronostic demeure péjoratif avec une survie
globale, tous stades confondus, inférieure à 10% à 5 ans. La pathologie est très complexe eu égard aux divers
aspects épidémiologiques, étiologiques, histologiques expliquant des évolutions naturelles bien différentes. Les
cancers gastriques constituent une entité hétérogène ce qui anime les réflexions et controverses à propos de
leur prise en charge, difficile à standardiser. A l’instar des débats chirurgicaux autour du type de gastrectomie
et surtout de l’étendue du curage ganglionnaire, les discussions sur la place et l’intérêt des traitements non
chirurgicaux, chimiothérapie et/ou radiothérapie, adjuvant ou néo-adjuvant, ont ajouté à la complexité de la
réflexion sur la prise en charge optimale et les moyens d’améliorer le pronostic. Il faut en effet souligner que
les études de phase III sont relativement peu nombreuses et comportent souvent un nombre limité de
malades, incluant parfois les cancers du cardia. La puissance statistique des résultats s’en trouve amoindrie,
rendant nécessaire le recours aux méta-analyses pour conclure. Actuellement la chirurgie est le traitement
standard à visée curative mais avec les progrès des traitements non chirurgicaux, il est de plus en plus admis
que la prise en charge de l’adénocarcinome gastrique est devenue résolument pluridisciplinaire. Chaque
situation doit donc être évoquée en réunion de concertation pluridisciplinaire avant la prise en charge
thérapeutique du malade.
Les traitements adjuvants sont réalisés au décours d’une chirurgie optimale à visée curative, en
connaissance des facteurs pronostiques, et concernent les malades généralement atteints d’une tumeur avec
extension ganglionnaire. Les études ont porté soit sur la chimiothérapie exclusive, soit sur une combinaison
chimio-radiothérapie.
La chimiothérapie adjuvante est étudiée depuis plus de 20 ans, utilisant des protocoles très divers. Le
bénéfice qu’elle apporte est reconnu au Japon et en Asie du Sud Est alors qu’il reste incertain en Europe et aux
Etats-Unis où, néanmoins, le recours aux méta-analyses permet de mieux préciser son intérêt. Ainsi, les
données d’un grand nombre de malades inclus dans des études randomisées sont regroupées pour comparer
les résultats obtenus avec une chirurgie à visée curative, soit seule, soit suivie d’une chimiothérapie
postopératoire. Cela permet une analyse plus représentative des résultats et aboutit à des conclusions de
meilleure significativité. Plusieurs méta-analyses peuvent ainsi rapportées dont les résultats sont concordants,
indépendamment du type de chimiothérapie qui a varié selon les études.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%