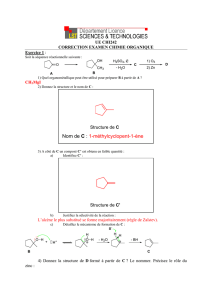
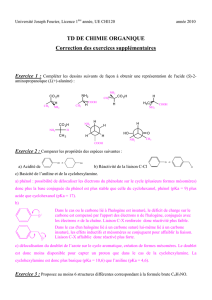
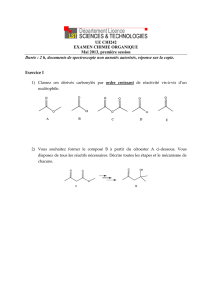
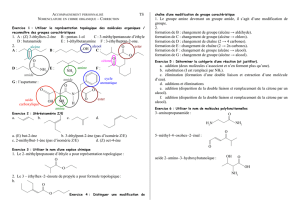
Description des principales fonctions EC1 : Chimie organique PACES 2016-2017

Description des principales fonctions
PACES 2016-2017
Professeur Pascal Marchand
IICiMed, Laboratoire de Chimie Thérapeutique
Faculté de Pharmacie de Nantes
UE1 : Atome - Biomolécules – Génome - Bioénergétique – Métabolisme
EC1 : Chimie organique

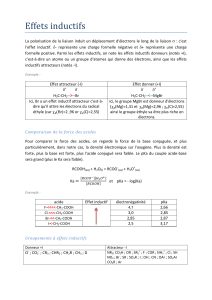
• Remplacement d’un ou de plusieurs Hpar un ou plusieurs Xsur un carbone
• Formule générale :
RX
≡
CX
1. Dérivés halogénés non aromatiques
•Acycliques : Exemples :
CH3CH
CH3
I
2-iodopropane
CH3C
CH3
CH2
CH3
Br
1-bromo-2,2-diméthylpropane
Nomenclature systématique : halogène considéré comme un substituant de l’alcane
= halogénoalcanes
Nomenclature plus ancienne : halogénures d’alkyle
CH3Cl Chlorométhane (chlorure de méthyle)
CHCl3Trichlorométhane (trichlorure de méthyle)
Chloroforme
CBrCl3Bromotrichlorométhane (bromure de trichlorométhyle)
Les dérivés halogénésLes dérivés halogénés
I- Définition et nomenclature

• Dérivés aromatiques « à halogènes séparés » : halogénures benzyliques
Exemple :
CH2Br
(bromure de benzyle)
(bromométhyl)benzène
II- Structure
CX
-I +
CX
δ
δ-
Polarisation de la liaison
ELCF > ELCCl > ELCBr > ELCI
Electronégativité : les halogènes sont plus électronégatifs que le C
Taille de l’halogène croissante Electronégativité décroissante

R CH2
X
R
CH
X
R'
R
C
X
R'
R"
Primaire Secondaire Tertiaire
Taille de la liaison :
Exemple :
Existence de 3 classes de monohalogénoalcanes :
CCl
1,76 Å

III- Propriétés chimiques
1. Réactivité générale
1.1 Polarisabilité de la liaison
+
CX
δ
δ-
CCl
δδ
Exemples :
CH2CH CH2Cl
δδ
CH2Cl
δδ
La polarisabilité augmente en fonction :
De la diminution de l’énergie de liaison
De l’augmentation de la taille de X
F << Cl < Br < I
Dérivés R-F sont presque inertes chimiquement
Les dérivés chlorés, bromés et iodés représentent une
source potentielle de carbocations
= ce sont des composés électrophiles (sites pauvres en électrons)
Réactivité croissante
La liaison C-F est très stable Pas de SN ni de β-élimination
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%