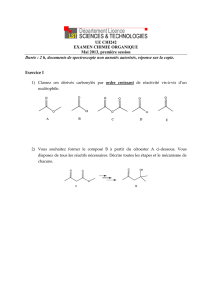
Effetsinductifs
Lapolarisationdelaliaisoninduitundéplacementd'électronslelongdelaliaison:c'est
l'effetinductif.‐ représenteunechargeformellenégativeet+représenteunecharge
formellepositive.Parmileseffetsinductifs,onnoteleseffetsinductifsdonneurs(notés+I),
c'est‐à‐direunatomeouungrouped'atomesquidonnedesélectrons,ainsiqueleseffets
inductifsattracteurs(notés‐I).
Exemple:
Effetattracteur(‐I)Effetdonner(+I)
+
‐
H
3
C‐CH
2
‐‐
>
‐‐Br
‐
+
H
3
C‐CH
2
‐‐
<
‐‐MgBr
Ici,Brauneffetinductifattracteurc'est‐à‐
direqu'ilattirelesélectronsduradical
éthyle(car
p
r)=2,96or
p
(C)=2,55)
Ici,legroupeMgBrestdonneurd'électrons
(
p
(Mg)=1,31et
p
(Mg)=2,96;
p
(C)=2,55)
ainsilegroupeéthylevaêtreplusricheen
électrons.
Comparaisondelaforcedesacides
Pourcomparerlaforcedesacides,onregardelaforcedelabaseconjuguée,etplus
particulièrement,dansnotrecas,ladensitéélectroniquesurl'oxygène.Plusladensitéest
forte,pluslabaseestforte,plusl'acideconjuguéserafaible.LepKaducoupleacide‐base
seragrand(plusleKaserafaible).
RCOOH
(aq)
+H
2
O
(l)
=RCOO
‐
(aq)
+H
3
O
+
(aq)
Ka
etpKa=‐log(Ka)
Exemple:
acideEffetinductifélectronégativitépKa
F‐
<<<<
‐CH2‐COOH
4,7
2,66
Cl‐
<<<
‐CH2‐COOH
3,02,85
Br‐
<<
‐CH2‐COOH
2,852,87
I‐
<
‐CH2‐COOH
2,53,17
Groupementsàeffetsinductifs
Donneur+IAttracteur‐I
O
‐
;CO
2
‐
;CR
3
;CHR
2
;CH
2
R;CH
3
;D
NR3;CO2H;OR;SR2
+;F;COR;NH3
+;Cl;SH
NO2;Br;SR;SO2R;I;OH;CN;OAr;SO2Ar
CO2R;Ar
1
/
1
100%