Nous de faisons

éditorial
éditorial
La Lettre du Neurologue - Vol. XI - n° 6 - juin 2007
Ns s d s p ité s
r p it
Ns s d s p ité s
r p it
199
Directeur de la publication : Claudie Damour-Terrasson
Rédacteur en chef : Pr P. Amarenco (Paris)
Rédacteur en chef adjoint : Dr M. Sarazin (Paris)
Secrétaire scientifique : A. Kemmel
Comité de rédaction
Dr J. d’Anglejan-Chatillon (Versailles) - Pr P. Azouvi (Garches)
Dr A. Béhin (Paris) - Dr P. Bouche (Paris)
Dr P. Derkinderen (Nantes) - Dr S. Dupont (Paris)
Dr O. Heinzlef (Poissy) - Dr M. Kalamarides (Clichy)
Dr F. Laigle-Donadey (Paris) - Dr T. Maisonobe (Paris)
Pr J.M. Pinard (Garches) -
Dr P.F. Pradat (Paris)
Dr P.J. Touboul (Paris) - Dr J.M. Visy (Reims)
Conseil de rédaction
Pr S. Bakchine (Reims) - Pr H. Chabriat (Paris)
Pr J.Y. Delattre (Paris) - Pr B. Dubois (Paris) - P. Krack (Grenoble)
Pr C. Lubetzki (Paris) - Pr F. Parker (Le Kremlin-Bicêtre)
Pr P. Pollak (Grenoble) - Pr J.P. Pruvo (Lille)
Pr M.J. Vidailhet (Paris)
Conseillers scientifiques
Pr Y. Agid (Paris) - Pr J.C. Baron (Cambridge, UK)
Pr M.G. Bousser (Paris) - Pr M. Chatel (Nice)
Pr P. Chauvel (Marseille) - Pr M. Clanet (Toulouse)
Dr P. Davous (Paris) - Pr C. Marescaux (Strasbourg)
Pr F. Mauguière (Lyon) - Dr B. Montagne (Roubaix)
Pr J.M. Orgogozo (Bordeaux) - Pr J. Perret (Grenoble)
Pr G. Saïd (Le Kremlin-Bicêtre) - Pr E. Tournier-Lasserve (Paris)
Comité de lecture
Professeurs et docteurs : G. Amarenco - I. Arnulf
A. Arzmanoglou - P. Bedoucha - S. Blond - A. Bonafé
J. Boulliat - O. Bœspfl ug-Tanguy - S. Bracard - L. Brunereau
J.B. Cesari - B. Chabrol - P. Chaine - J.M. Chamouard
G. Chauplannaz - F. Chedru - P. Clavelou - C. Confavreux
J.M. de Bray - T. de Broucker - F. Demenais - A. Destée
A. Dusser - C. Duyckaerts - B. Eymard - B. Fontaine
F. Forette - J.M. Gaio - P. Galetti - M. Gonce - P. Gorce
F. Gray - N. Graziani - M. Gugenheim - D. Hannequin
P. Hinault - O. Heinzlef - E. Hirsch - K. Hoang-Xuan
J. Honnorat - P. Kahane - G. Leftheriotis - J. Le Guyader
C. Lévy - D. Leys - H. Loiseau - G. Lot - D. Malapert
M.H. Marion - P. Masnou - H. Massiou - J. Melki - A. Monjour
T. Moulin - A. Moulonguet - P. Neuschwander - P. Niclot
F. Pasquier - S. Peudenier - V. Plante-Bordeneuve - O. Rascol
J. Reis - P. Rémy - G. Rodesch - D. Rodriguez - D. Rougemont
E. Roullet - M. Sanson - J. Touchon - F. Turjman - L. Vallée
M. Vérin - P. Vermersch - J.M. Verret - H. Vespignani
F. Viallet - J. Vrigneaud - S. Zemrag
Société éditrice : EDIMARK SAS
Président-directeur général
Claudie Damour-Terrasson
Tél. : 01 46 67 63 00 – Fax : 01 46 67 63 10
Rédaction
Secrétaire générale de la rédaction : Magali Pelleau
Secrétaire de rédaction : Laurence Ménardais
Rédactrices-réviseuses : Cécile Clerc, Sylvie Duverger,
Muriel Lejeune, Catherine Mathis, Odile Prébin
Infographie
Premier rédacteur graphiste : Didier Arnoult
Responsable technique : Virginie Malicot
Rédactrices graphistes : Mathilde Aimée,
Christine Brianchon, Cécile Chassériau
Dessinateurs d’exécution : Stéphanie Dairain,
Antoine Palacio
Commercial
Directeur du développement commercial
Sophia Huleux-Netchevitch
Directeur des ventes : Chantal Géribi
Directeur d’unité : Béatrice Tisserand
Régie publicitaire et annonces professionnelles
Valérie Glatin
Tél. : 01 46 67 62 77 – Fax : 01 46 67 63 10
Abonnements : Lorraine Figuière (01 46 67 62 74)
2, rue Sainte-Marie - 92418 Courbevoie Cedex
Tél. : 01 46 67 63 00 – Fax : 01 46 67 63 10
E-mail : [email protected]
Site Internet : http://www.edimark.fr
Adhérent au SNPM
Revue indexée dans la base PASCAL
Crédits photos (couverture) : © Goodshoot - © stockdisc
La Lettre du Neurologue
Démence parkinsonienne :
quand et comment traiter ?
Dementia associated with Parkinson’s disease:
when and how to treat?
●●
O. Moreaud*, P. Krack**
L
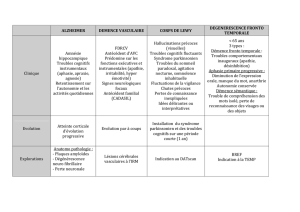
a démence parkinsonienne (DP) se défi nit comme un syndrome
démentiel survenant chez un patient atteint d’une maladie de
Parkinson (MP). Elle altère principalement l’attention et les
fonctions exécutives ; l’intensité des troubles de la mémoire est moindre
que dans la maladie d’Alzheimer (MA), et qualitativement diff érente (on
constate surtout des diffi cultés de rappel et d’évocation). Elle survient
habituellement après 8 à 10 ans d’évolution, mais il peut y avoir de
grandes variations. On estimait traditionnellement à 40 % la prévalence
de la démence dans une population de patients parkinsoniens, mais
une étude longitudinale récente retrouve une prévalence cumulée de la
démence de 78 % à 8 ans (1). Une proportion substantielle de patients
souff rant d’une MP va donc développer une démence.
L’âge est le principal facteur associé à sa survenue. Les autres facteurs
de risque sont la sévérité du syndrome parkinsonien, notamment des
signes dits “axiaux” (rigidité nucale, instabilité posturale, troubles de la
marche, dysarthrie), la présence de troubles cognitifs dont l’intensité
n’est pas suffisante pour porter le diagnostic de démence, et l’appari-
tion d’hallucinations visuelles sous traitement dopaminergique stable,
bien toléré auparavant aux mêmes doses. La DP grève le pronostic
de la MP, puisqu’elle augmente le taux d’institutionnalisations et de
décès.
Un déficit cholinergique qui résulte de la dénervation des neurones
cholinergiques du noyau de Meynert projetant sur le cortex frontal
est supposé être à la base du syndrome dysexécutif de la MP (2).
Grâce à l’immunomarquage de l’alpha-synucléine, on a aussi pu
montrer que les hallucinations et la démence sont hautement corré-
lées à la présence de corps de Lewy dans les structures limbiques et le
néocortex (3). L’obser vation de corps de Lewy corticaux dans la MP a
* Unité de neuropsychologie, département de neurologie et CMRR, CHU de Grenoble.
** Unité de pathologie du mouvement, département de neurologie, CHU de Grenoble.

éditorial
éditorial
La Lettre du Neurologue - Vol. XI - n° 6 - juin 2007
200
soulevé la question de savoir s’il est encore judicieux de
distinguer la DP (démence survenant chez un malade
porteur d’une MP) et la démence à corps de Lewy (DCL)
[démence survenant de novo, associée dès le début ou
ultérieurement à un syndrome parkinsonien], deux
pathologies qui semblent être deux extrêmes du même
spectre neuropathologique et clinique. La distinction
clinique est néanmoins maintenue dans les critères de
diagnostic revus récemment.
L’évolution des troubles cognitifs dans la MP est inexo-
rable et se fait en général très lentement, au point que
Parkinson avait jugé que l’intellect n’était pas touché
dans la maladie qui porte son nom. Le syndrome
dysexécutif est présent longtemps avant l’installation
de la démence, avec un retentissement variable sur les
activités du patient. Il peut être facilement suspecté à
l’interrogatoire du patient et de son entourage, qui relè-
vent une lenteur, des difficultés dans les conversations,
avec phénomène du “mot sur le bout de la langue”,
et des troubles de la concentration. On peut assimiler
ces symptômes à la bradyphrénie. Des tests simples,
facilement réalisables par le neurologue, peuvent être
suffisants pour mettre en évidence les troubles cogni-
tifs qui prédominent sur les fonctions exécutives. Un
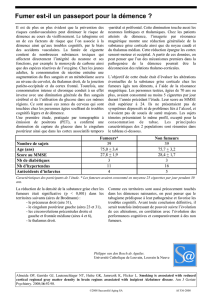
profil assez caractéristique est observé : le Mini Mental
Test est habituellement dans les limites de la normale,
car il est peu sensible à ces troubles, mais on note une
diminution des performances à la Batterie rapide
d’efficience frontale et aux tâches de fluence verbale,
ainsi qu’une baisse du rappel différé libre avec norma-
lisation par l’indiçage à l’épreuve des 5 mots. Il faut
apprécier le retentissement de ces troubles dans la vie
quotidienne du patient. Lorsque ces tests simples sont
altérés, il est souvent déjà notable, avec une gêne dans
les activités professionnelles et sociales, et éventuelle-
ment une altération dans les activités instrumentales
de la vie quotidienne (la préparation des médicaments,
par exemple). Néanmoins, même en l’absence de reten-
tissement net, et même lorsque les tests précédents
sont normaux, une évaluation neuropsychologique
plus complète, réalisée au mieux par un neuropsy-
chologue ayant une expérience dans le domaine, peut
mettre en évidence des troubles des fonctions exécu-
tives et de la mémoire de travail, et des troubles de
la mémoire à long terme entrant dans ce cadre. Les
épreuves utilisées sont variées, allant des échelles
globales du type Dementia Rating Scale de Mattis aux
épreuves plus analytiques combinant différents tests
(Trail Making Test A et B, Stroop Test, tests de classe-
ment du type Wisconsin, fluences, empan envers, etc.).
Les tâches d’apprentissage verbal à long terme de
type Grober et Buschke (RL/RI16) montrent de façon
caractéristique une chute du rappel libre immédiat,
très améliorée par l’indiçage, non aggravée en rappel
différé, et normalisée par la reconnaissance. On peut
proposer en pratique de réaliser ce bilan dès lors que
le patient ou l’entourage se plaint et exprime une gêne
dans la vie quotidienne, alors que les tests simples ne
montrent pas d’altération. Il faudra tenir compte de
certains facteurs qui peuvent interférer avec la passa-
tion des tests et générer un pattern de performances
proche : dépression, apathie, gêne motrice, prise d’un
traitement anticholinergique.
L’évolution peut être émaillée d’hallucinations favo-
risées par les médications dopaminergiques, et ces
hallucinations peuvent être des signes précurseurs de
la démence. Le syndrome dysexécutif peut répondre
partiellement à la L-dopa. Cependant, l’impact global
de la dopathérapie sur les troubles cognitifs reste très
modeste, et va surtout dans le sens d’un effet moti-
vationnel et non pas d’une vraie amélioration du
syndrome dysexécutif. C’est surtout l’atteinte choli-
nergique qui semble responsable du syndrome dysexé-
cutif au cœur de la DP (on sait aussi que l’injection
intraveineuse de scopolamine chez des parkinsoniens
sans troubles cognitifs provoque de façon spécifique
un syndrome dysexécutif) [2]. Cela explique le fait que
le retentissement des troubles des fonctions exécu-
tives peut être longtemps faible chez le parkinsonien
jeune avec une bonne réserve cognitive, tant que l’at-
teinte corticale de la synucléinopathie n’est pas trop
importante. L’utilisation des anticholinestérasiques
centraux, préconisés dans la MA, était donc licite
pour tenter d’améliorer les symptômes cognitifs et

éditorial
éditorial
La Lettre du Neurologue - Vol. XI - n° 6 - juin 2007
201
comportementaux de la DP. De petits essais ouverts
ont suggéré une efficacité de la tacrine, du donépézil,
de la rivastigmine et de la galantamine, mais il n’existe
que peu d’essais randomisés en double aveugle. Ces
essais sont conduits avec des outils développés pour
la MA, assez peu sensibles aux déficits cognitifs de la
DP, ce qui rend leurs résultats positifs d’autant plus
intéressants. Une étude avait montré une efficacité de
la rivastigmine dans la DCL (4). Un essai de grande
envergure, dans lequel 541 patients atteints de DP ont
été enrôlés (parmi lesquels 410 ont terminé l’essai), a
été conduit avec cette molécule pendant 24 semaines
(5). Les patients présentaient une démence légère à
modérément sévère (MMSE 10-24). Un bénéfice du
traitement (dose moyenne : 8,7 mg par jour) a été
observé sur toutes les mesures d’évaluation : cogni-
tion (incluant notamment la fluence verbale et le test
de l’horloge), comportement (amélioration des scores
globaux d’une version à 10 items de l’Inventaire
neuropsychiatrique), impression clinique globale et
activités de la vie quotidienne. L’hypertonie et la brady-
kinésie n’ont pas été aggravées, mais l’accentuation
du tremblement était plus fréquemment rapportée
dans le groupe traité. Les effets secondaires digestifs
(nausées et vomissements) étaient plus fréquents que
sous placebo, et constituaient une raison fréquente
de sortie d’essai. Cet essai a conduit à une extension
d’AMM de la rivastigmine en Europe pour le traite-
ment des “démences légères à modérément sévères
associées à la MP”. Doit-on pour autant traiter systé-
matiquement tous les patients dès l’apparition de
troubles cognitifs ? À notre avis, un inhibiteur central
des cholinestérases devrait être envisagé chez des
patients parkinsoniens présentant des troubles cogni-
tifs caractéristiques (lenteur, syndrome dysexécutif,
trouble du rappel amélioré par l’indiçage) retentis-
sant sur les activités, après arrêt des anticholinergi-
ques et de l’amantadine, substitution des agonistes
dopaminergiques par la L-dopa et traitement d’un
éventuel syndrome dépressif sous-jacent. Même si l’on
ne dispose pas de données très claires sur la ques-
tion dans la DP, les résultats obtenus dans la DCL (4)
permettent d’envisager aussi la prescription après un
épisode confusionnel ou en cas de persistance d’hal-
lucinations visuelles mal tolérées malgré l’arrêt des
traitements favorisant leur apparition, ou encore en
cas d’apathie sévère. La titration des doses doit être
prudente et très progressive, de façon à limiter le
risque de nausées et d’aggravation du tremblement.
Chez les patients les plus âgés, on se méfiera du risque
cardiovasculaire (bradycardie, hypotension), et on
recommandera un examen complet avec ECG avant
la prescription. Dans la mesure où aucune étude n’a
dépassé 24 semaines, il faudra évaluer régulièrement
le bénéfice clinique de ce traitement. Si des halluci-
nations mal tolérées subsistent sous traitement anti-
cholinestérasique, on discutera la prescription de
clozapine. Bien entendu, les prescriptions médica-
menteuses doivent être accompagnées de toutes les
mesures médico-sociales utiles à la prise en charge des
patients avec troubles cognitifs et de leur entourage.
En somme, l’arrivée des inhibiteurs des cholines-
térases – même si ces traitements ont des limites
évidentes, puisqu’ils s’adressent au déficit choliner-
gique sans contrecarrer le développement et les effets
de la synucléinopathie corticale – constitue un progrès
certain dans la prise en charge de la DP. On voit aussi,
si l’on en doutait, que la prise en charge des patients
parkinsoniens ne se limite pas aux signes moteurs,
et qu’une évaluation régulière de la cognition et du
comportement est nécessaire. ■
RéféRences bibliogRaphiques
1. Aarsland D, Andersen K, Larsen JP et al. Prevalence and characteristics of
dementia in Parkinson’s disease: an 8-year prospective study. Arch Neurol 2003;
60:387-92.
2. Dubois B, Danze F, Pillon B et al. Cholinergic-dependent cognitive defi cits in
Parkinson’s disease. Ann Neurol 1987;22:26-30.
3. Williams DR, Lees AJ. Visual hallucinations in the diagnosis of idiopathic
Parkinson’s disease: a retrospective autopsy study. Lancet Neurol 2005;4:605-10.
4. McKeith I, Del Ser T, Spano P et al. Effi cacy of rivastigmine in dementia with
Lewy bodies: a randomised, double-blind, placebo-controlled international
study. Lancet 2000;356:2031-6.
5. Emre M, Aarsland D, Albanese A et al. Rivastigmine for dementia associated
with Parkinson’s disease. N Engl J Med 2004;351:2509-18.
1
/
3
100%