Wolff-Parkinson-White et échocardiographie doppler : mieux vaut tard que jamais C

CAS CLINIQUE
La Lettre du Cardiologue - n° 325 - février 2000
14
OBSERVATION
M. Yann B., 32 ans, consulte en raison de la sensation récente
d’un ralentissement brutal de son rythme cardiaque à l’effort.
Cela paraît d’autant plus inhabituel à ce jeune patient qu’il est
suivi depuis l’âge de 12 jours pour un rythme réciproque sur un
faisceau de Kent et est plus coutumier d’épisodes de tachycar-
die. Initialement patent, postérieur gauche, le Kent est rapide-
ment devenu latent. Plusieurs traitements antiarythmiques ont été
proposés jusqu’en 1996, où la prescription de flécaïnide a pro-
voqué un passage en bloc auriculoventriculaire (BAV) 2/1 régres-
sif à l’arrêt du traitement ; depuis cette période, le patient ne prend
plus aucun traitement à visée cardiologique et ne ressent plus
d’accès de tachycardie.
L’examen clinique cardiovasculaire est sans grande particularité :
on note uniquement un discret souffle systolique endapexien.
L’électrocardiogramme actuel est sinusal à 70/mn, avec un espace
PR normal (20 centièmes de seconde ) et des complexes QRS fins
sans anomalie notable.
À l’issue de la consultation, un électrocardiogramme d’effort et
une échocardiographie doppler sont proposés au patient :
–L’électrocardiogramme d’effort authentifie un BAV de type
Mobitz II en phase III survenant brutalement pour une puis-
sance de 120 watts et une fréquence cardiaque à 160/mn
(figure 1).
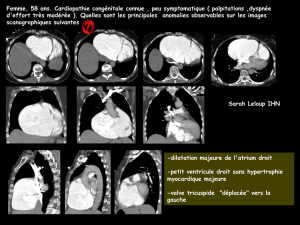
–L’échocardiographie doppler, examen réalisé pour la première
fois chez ce jeune patient, diagnostique une transposition corri-
gée des gros vaisseaux sans autre anomalie associée : absence
de communication interventriculaire, de sténose pulmonaire,
d’Ebstein... (figures 2 et 3). La fonction du ventricule systémique
(anatomiquement, ventricule droit) est satisfaisante, avec absence
de dilatation cavitaire et pourcentage de raccourcissement à 30 %.
Il existe une fuite auriculoventriculaire systémique modérée avec
une surface du jet mesurée à 3 cm2en doppler couleur (anatomi-
quement, sur valve tricuspide).
Wolff-Parkinson-White et échocardiographie doppler :
mieux vaut tard que jamais
●C. Adams*, B. Cauchemez**, O. Thomas**
* Service de cardiologie, C.H. Victor-Dupouy, Argenteuil.
** Rythmologie-Stimulation cardiaque, Centre médico-chirurgical
Ambroise-Paré, Neuilly-sur-Seine.
Figure 1. Tracé de l’électrocardiogramme d’effort à 120 watts : survenue
brutale d’un bloc auriculoventriculaire de type Mobitz II responsable du
brusque ralentissement de la fréquence cardiaque de 160/mn à 80/mn
(flèche).
Figure 2. Échocardiographie transthoracique coupe apicale 4 cavités.
Transposition corrigée des gros vaisseaux : le ventricule systémique est un ven-
tricule droit anatomique (VD) communiquant avec l’oreillette gauche (OG) par
l’intermédiaire d’une valve auriculoventriculaire systémique anatomiquement
tricuspide. L’oreillette droite (OD) est connectée au ventricule gauche anato-
mique (VG) par l’intermédiaire d’une valve mitrale.

La pose d’un pacemaker DDD est retenue, précédée d’une
exploration électrophysiologique pour évaluer préalablement
l’interférence possible du Kent sur ce mode de stimulation et
discuter la nécessité d’une ablation par radiofréquence du fais-
ceau accessoire. L’examen confirme le bloc de siège intrahis-
sien, avec un His en position atrioventriculaire très antérieure,
et constate l’involution complète du faisceau de Kent, en rétro-
grade en particulier, prévenant ainsi toute complication poten-
tielle avec la stimulation double chambre, notamment de type
réentrée électronique. Un pacemaker double chambre est mis
en place.
À un an, le patient mène une vie normale, pratiquant occasion-
nellement le jogging et le ski sans gêne fonctionnelle. En écho-
cardiographie doppler, la fonction du ventricule systémique et la
fuite auriculoventriculaire systémique sont stables.
DISCUSSION
L’observation de ce patient suscite plusieurs commentaires.
✔Ce cas clinique souligne l’intérêt de l’échocardiographie
doppler en cas de syndrome de Wolff-Parkinson-White. Si,
dans 60 % à 80 % des cas, il n’existe pas d’anomalie cardiaque
sous-jacente, une étiologie, en particulier congénitale, doit être
recherchée : en premier lieu, malformation d’Ebstein, puis, à
l’instar de notre observation, transposition corrigée des gros vais-
seaux, mais aussi cardiomyopathie hypertrophique obstructive
ou non, prolapsus valvulaire mitral, atrésie tricuspide ou mitrale,
communication interventriculaire ou interauriculaire, persistance
du canal artériel, coarctation de l’aorte, diverticule du sinus coro-
naire, etc. (1). La grande majorité de ces pathologies est aisé-
ment diagnostiquée de manière non invasive par l’échocardio-
graphie doppler transthoracique. La transposition corrigée des
gros vaisseaux connecte l’oreillette droite au ventricule gauche
par l’intermédiaire d’une valve mitrale, puis le ventricule gauche
à l’artère pulmonaire ; l’oreillette gauche communique avec le
ventricule droit par l’intermédiaire d’une valve tricuspide, et le
ventricule droit éjecte son contenu vers l’aorte. L’artère pulmo-
naire transposée est en situation basse en continuité mitrale et
tricuspide et l’aorte est haute habituellement en avant et à gauche.
L’échocardiographie doppler participe également au diagnostic
d’anomalies cardiaques associées : le plus souvent, communi-
cation interventriculaire, sténose pulmonaire, malformation
d’Ebstein.
✔Le diagnostic de la cardiopathie congénitale sous-jacente a été
effectué ici lors de la survenue de troubles conductifs : déjà, en
1996, une tentative de traitement antiarythmique par la flécaïnide
avait dû être interrompue en raison de l’apparition d’un BAV du
deuxième degré, régressif à l’arrêt ; l’électrocardiogramme d’effort
a objectivé un Mobitz II en phase III sur des complexes QRS fins,
très caractéristique du siège intrahissien du bloc. L’apparition
d’un BAV est une complication habituelle de la transposition
corrigée des gros vaisseaux, mise sur le compte d’une position
anormale du nœud auriculoventriculaire et du faisceau de His, ainsi
que cela a été constaté lors de l’exploration électrophysiologique
de notre patient ; on estime sa fréquence à 2 % par an.
Sur une série de 17 patients, Daliento (2) évalue la fréquence des
BAV du premier degré à 12 % et celle des BAV complets à 29 %,
les cas apparaissant à un âge moyen de 15,8 ans. Pour deux
patients, on observe une évolution du BAV des premier et second
degrés au BAV complet évoquant une altération progressive des
voies de conduction auriculoventriculaires.
Parmi 52 patients âgés de plus de 18 ans suivis à Toronto (3), 18
ont été appareillés par pacemakers permanents, dans la moitié des
cas pour BAV d’aggravation progressive ou BAV complet dia-
gnostiqué d’emblée, et dans l’autre moitié des cas pour BAV com-
plet postopératoire en dépit d’une attention particulière pour évi-
ter de léser les voies de conduction pendant le geste chirurgical.
✔La survenue de troubles conductifs dans le contexte d’un syn-
drome de Wolff-Parkinson-White est peu fréquente. Elle peut,
comme dans la présente observation, constituer un mode de “gué-
rison” des accès de rythme réciproque, le blocage antérograde de
la conduction dans le faisceau de His, dès l’accélération du
rythme, prévenant la pérennisation de la tachycardie. Dans le
cadre d’une stimulation double chambre, l’existence d’une
conduction rétrograde fiable en 1/1 dans le faisceau de Kent com-
plique la stimulation, car elle peut faciliter la survenue de rythmes
réciproques électroniques. En fait, dans le cas présent, ce pro-
blème potentiel ne se posait pas, le faisceau de Kent ayant spon-
tanément involué. Ce phénomène d’involution spontanée des
faisceaux accessoires est bien connu chez l’enfant, durant la pre-
mière année de vie. Il est beaucoup plus rare chez l’adulte, pour
la conduction rétrograde en particulier (4).
✔La transposition corrigée des gros vaisseaux est une patholo-
gie rare correspondant à environ 1 % des cardiopathies congéni-
tales. Son pronostic est loin d’être aussi favorable que pourrait le
laisser penser notre observation : la série de Connelly (3) objec-
tive 13 décès sur 52 patients (25 %), et, pour ces patients âgés de
plus de 18 ans à leur inclusion dans l’étude, l’âge moyen lors du
décès est de 38,5 ± 12,5 ans. Favorisée par l’absence d’anoma-
lie cardiaque associée, la méconnaissance du diagnostic pour
La Lettre du Cardiologue - n° 325 - février 2000
15
CAS CLINIQUE
Figure 3. Échocardiographie transthoracique : tracé TM de la valve
auriculoventriculaire systémique, correspondant à un enregistrement de
valve morphologiquement tricuspide.

La Lettre du Cardiologue - n° 325 - février 2000
16
CAS CLINIQUE
notre patient est sans doute le fait d’une excellente tolérance jus-
qu’à l’apparition des troubles conductifs. La découverte tardive,
à l’âge adulte, de la transposition corrigée des gros vaisseaux est
la conséquence d’une capacité d’adaptation du ventricule droit
au régime de pressions systémiques pour certains patients : Ikeda
(5) a ainsi colligé quatre observations pour lesquelles le diagnostic
a été posé entre 54 et 67 ans, avec, pour deux d’entre elles, la
seule constatation d’anomalies électrocardiographiques condui-
sant à un bilan cardiologique permettant d’authentifier la patho-
logie congénitale sous-jacente. Habituellement, l’évolution est
plus péjorative, surtout en raison de la défaillance du ventricule
droit en position systémique et de la régurgitation valvulaire
auriculoventriculaire systémique tricuspide (IT). Ces deux
complications sont intriquées et il est difficile d’individualiser la
cause et la conséquence, mais une publication récente de Prieto
(6) portant sur le suivi de 40 patients implique en premier lieu
l’IT : en analyse multivariée, seule l’IT est un facteur de risque
indépendant de mortalité (p = 0,01), et seules des anomalies mor-
phologiques de la valve, présentes chez 70 % des patients exa-
minés – aspect de type Ebstein, dysplasie, hypoplasie – prédisent
l’IT (p = 0,03). La survie à 20 ans est de 93 % en l’absence d’IT
et de 49 % en présence d’une IT. Il en est de même si l’on dis-
tingue les sujets opérés ou non (chiffres respectifs pour les sujets
opérés : 90 % et 34 %, et pour les non opérés : 100 % et 60 %).
La défaillance ventriculaire droite serait donc plus souvent la
conséquence de l’IT que le processus primaire, le ventricule droit
en position systémique apparaissant moins tolérant à la régurgi-
tation auriculoventriculaire qu’un ventricule gauche normal à une
fuite mitrale. Notre patient, indemne de défaillance ventriculaire
systémique et présentant une IT actuellement modérée, nécessi-
tera un suivi annuel clinique et échocardiographique pour éva-
luer le devenir de ces deux données essentielles au pronostic
ultérieur. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Gallay P., Grolleau R., Nicolai P. Les préexcitations ventriculaires. Les
troubles du rythme cardiaque ; acquisitions actuelles, par le Groupe de
Rythmique de la Société Française de Cardiologie. Ed. Maloine 1993 ; 141-54.
2. Daliento L., Corrado D., Buja G., John N., Nava A., Thiene G. Rhythm and
conduction disturbances in isolated, congenitally corrected transposition of the
great arteries. Am J Cardiol 1986 ; 58 : 314-8.
3. Connelly M.S., Liu P.P., Williams W.G., Webb G.D., Robertson P.,
McLaughlin P.R.
Congenitally corrected transposition of the great arteries in the
adult : functional status and complications. J Am Coll Cardiol 1996 ; 27 : 1238-43.
4. Chen S.A., Chiang C.E., Tai C.T. et coll. Longitudinal clinical and electrophy-
siological assessment of patients with symptomatic Wolff-Parkinson-White syn-
drome and atrioventricular node reentrant tachycardia. Circulation 1996 ; 93 :
2023-32.
5. Ikeda U., Furuse M., Suzuki O., Kimura K., Sekiguchi H., Shimada K. Long-
term survival in aged patients with corrected transposition of the great arteries.
Chest 1992 ; 101 : 1382-5.
6. Prieto L.R., Hordof A.J., Secic M., Rosenbaum M.S., Gersony W.M.
Progressive tricuspid valve disease in patients with congenitally corrected trans-
position of the great arteries. Circulation 1998 ; 98 : 997-1005.
Annonceurs
BRISTOL-MYERS SQUIBB/SANOFI∼SYNTHELABO
(CoAprovel), p. 12-13 ;
GLAXO WELLCOME (Pritor), p. 28 ;
KNOLL FRANCE (Isoptine LP), p. 17 ;
SANOFI∼SYNTHELABO (Trinipatch), p. 2.
1
/
3
100%