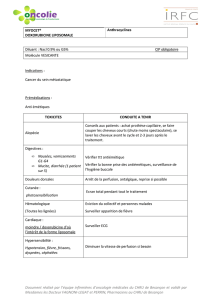
> Intérêt de la doxorubicine pégylée liposomale (Caelyx®)

26 La Lettre du Cancérologue - Suppl. Les Actualités au vol. XIV - n° 6 - décembre 2005
>Écho
des Congrès
L’objectif prioritaire du traite-
ment de première ligne méta-
statique est bien une améliora-
tion de la survie globale (SG)
À ce propos, la méta-analyse de P. Bruzzi
portant sur 2 126 patientes a montré
que la qualité de la réponse objective
obtenue en première ligne influençait
la survie (2). La SG médiane est de
28,8 mois (IC 95 : 25,4-45,3) en cas
de réponse complète, de 21,3 mois
pour les réponses partielles (IC 95 :
19,2-22,4) et de seulement 14,6 mois
(IC
95
: 13-15,4) chez les patientes
non répondeuses. La réponse en
première ligne métastatique est
un facteur hautement prédictif de
la survie (p < 0,0001).
Pour P. Conte, “ceci signifie
que la chimiothérapie
de première ligne se doit
d’être efficace et donc
d’utiliser les cytotoxiques
les plus puissants, dont les
anthracyclines. Le ‘rechallenge’
thérapeutique avec ce type
d’agent à l’efficacité prouvée
est une option thérapeutique
valable en première ligne
dans le cancer du sein”.
Les résultats obtenus dans la méta-ana-
lyse de A. Gennari avec l’association épi-
rubicine + paclitaxel en première ligne
métastatique vont dans ce sens (3). Une
population de 291 patientes traitées
>
Intérêt de la doxorubicine
pégylée liposomale (Caelyx®)
dans le “rechallenge” par anthracyclines
du cancer du sein métastatique*
Le Dr P. Conte de l’université de Modène (Italie) a résumé la problématique actuelle
de la chimiothérapie optimale du cancer du sein en situation métastatique. Si l’apport
démontré des taxanes (T) en association avec les anthracyclines (risque de rechute
réduit de 50-60 % avec une association anthracyclines + T) et du trastuzumab
chez les patientes avec tumeurs HER2+ (diminution de 39-52 % du risque de rechute
avec une association trastuzumab-4 chimiothérapie [CT]) est incontestable,
ce type de protocole thérapeutique soulève de nouveaux problèmes.
En termes de toxicité, le surcoût en cardiotoxicité (1,7-4,1 % d’insuffisance cardiaque
congestive) des associations triples anthracyclines + T + trastuzumab
n’est pas négligeable. L’incidence des dysfonctionnements cardiaques
dans les protocoles adjuvants contenant du trastuzumab ou associant anthracyclines
et T est élevée (27 % avec le protocole doxorubicine + cyclophosphamide [ACT]
+ trastuzumab versus 7 % sous AC et 13 % avec une association T + trastuzumab) [1].
L’amélioration de la tolérance, notamment cardiaque, de ces traitements adjuvants est
devenue essentielle, conduisant par exemple à préférer l’administration séquentielle
des anthracyclines traditionnelles et des T (4 cycles seulement avec anthracyclines).
* Symposium Schering-Plough Oncology - ECCO 13 (Paris, 30 octobre-3 novembre 2005)

27
La Lettre du Cancérologue - Suppl. Les Actualités au vol. XIV - n° 6 - décembre 2005
avec cette association dans 5 études a
été analysée : en adjuvant, 35 % n’avaient
pas reçu de CT, 37 % avaient eu une CT
sans anthracyclines et 28 % une CT à
base d’anthracyclines. Le taux global de
réponses de 66 %, la survie sans progres-
sion (SSP) médiane de 10-12 mois et la
SG médiane de 20-27 mois ne sont pas
influencés par le type de traitement
adjuvant.
Quelle anthracycline choisir
dans ce contexte de “rechallenge”
thérapeutique en première
ligne métastatique ?
La cardiotoxicité cumulative des anthra-
cyclines traditionnelles (doxorubicine
libre et épirubicine) utilisées en adju-
vant limite leur usage prolongé en pre-
mière ligne métastatique.
La doxorubicine pégylée liposomale
est, dans ce contexte, un agent de
choix, et ce pour plusieurs raisons :
✓
Efficacité sur la SG (21-23 mois)
en première ligne comparable à
celle de la doxorubicine libre selon
les résultats d’une étude de phase
III (n = 509 patientes) [4].
✓
Risque minime de cardiotoxicité com-
paré à celui de la doxorubicine libre,
même chez les patientes prétraitées en
adjuvant par anthracyclines (doxorubi-
cine libre HR = 3,16 ; p < 0,001) et
bonne tolérance globale (pas d’alopé-
cie, bonne tolérance digestive) [4].
✓
Bonne tolérance cardiaque en asso-
ciation avec le trastuzumab (diminution
de 10-15 % de la FEVG, sans signe
clinique d’IC : 13 %) couplée à une
haute efficacité (tableau) [5] ; il
en va de même dans le protocole ECOG
3198 (doxorubicine pégylée liposomale
+ docétaxel + trastuzumab) [6]. Dans
l’étude de phase II de Chia, 30 patientes
atteintes d’un cancer du sein avec
surexpression de HER2 ont été traitées
en situation métastatique par l’asso-
ciation doxorubicine pégylée liposo-
male (50 mg/m
2
/toutes les 4 semaines
x 6 cycles) + trastuzumab (4 mg/kg puis
2 mg/kg/semaine x 24 semaines) [5].
Quarante-trois pour cent des patientes
avaient reçu en adjuvant une CT à
base d’anthracyclines (dose cumulée
moyenne de doxorubicine de 251 mg/m
2
ou 530 mg/m
2
d’épirubicine). Le taux
global de réponses s’élève à 52 % et
demeure à ce niveau important, que les
patientes aient ou non reçu des anthra-
cyclines en adjuvant.
L’avis du Dr M. Piccard
(Institut Jules-Bordet,
Bruxelles), modératrice
de ce symposium, sur
le “rechallenge” par anthra-
cyclines grâce à la doxorubicine
pégylée liposomale
“Le ‘rechallenge’ par anthracyclines en
situation métastatique est pour moi
une option thérapeutique justifiée si
l’IL est long (> 12 mois) et en cas de
surexpression d’HER2 (facteurs prédic-
tifs d’une bonne sensibilité aux anthra-
cyclines). De plus, la mise à disposition
de la doxorubicine pégylée liposomale,
molécule efficace dont l’administration
présente un risque minime de cardio-
toxicité même chez des patientes pré-
traitées en adjuvant par anthracyclines,
nous permet désormais de retraiter
avec la doxorubicine pégylée liposo-
male avec une bonne sécurité d’emploi.
Si le trastuzumab a été administré
en adjuvant, j’utiliserai volontiers la
doxorubicine pégylée liposomale seule
à sa dose usuelle de 40-45 mg/m
2
, traite-
ment ayant l’avantage d’être peu contrai-
gnant car d’administration mensuelle.
En revanche, chez les patientes n’ayant
pas reçu du trastuzumab en adjuvant,
l’apport de cet agent utilisé seul ou
associé à un taxane n’est pas encore
clairement établi, mais il pourrait être
bénéfique quand la tumeur surexprime
HER2. Si, pour la patiente, l’absence
d’alopécie sous CT est vécue comme un
critère important, j’orienterai mon choix
de préférence vers l’association doxoru-
bicine pégylée liposomale + trastuzu-
mab en première ligne, réservant le taxane
à la seconde ligne. Tout cela se conçoit,
bien sûr, en fonction des facteurs de
risque cardiovasculaire. Enfin, les proto-
coles d’administration tous les 15 jours
de la doxorubicine pégylée liposomale à
la dose de 20 mg/m
2
sont intéressants,
car ils pourraient réduire l’incidence du
syndrome “mains-pieds”. De même, l’éva-
luation de l’administration séquentielle
de la doxorubicine pégylée liposomale
et d’un taxane doit se poursuivre en
situation métastatique”.
■
Références bibliographiques
1.
Seidman A, Hudis C, Pierri MK et al. Cardiac dys-
function in the trastuzumab clinical trials experience.
J Clin Oncol 2002;20(5):1156-21.
2.
Bruzzi P, Del Mastro L, Sormani MP et al. Objective
response to chemotherapy as a potential surrogate
end point in metastatic breast cancer patients. J Clin
Oncol 2005;23(22):5117-25.
3.
Gennari A, Bruzzi P, Orlandini C et al. Activity of first-
line epirubicin and paclitaxel in metastatic breast can-
cer is independent of type of adjuvant therapy. Br J
Cancer 2004;90(5):962-7.
4.
O’Brien MER, Wigler N, Inbar M et al. Reduced car-
diotoxicity and comparable efficacy in a phase III trial
of pegylated liposomal doxorubicin HCI (Caelyx®/
Doxil®) versus conventional doxorubicin for first-line
treatment of metastatic breast cancer. Ann Oncol
2004;15(3):440-9.
5.
Chia et al. Proc Am Soc Clin Oncol 2004;23:34; Abs-
tract 628.
6.
Wolff et al. Breast Cancer Res Treat 2004;88:S125;
Abstract 3040 + poster.
Nombre de patientes évaluables n = 29
Taux de réponses global 52 %
•Patientes sans anthracyclines en adjuvant 53 %
•Patientes prétraitées par anthracyclines 50 %
Survie sans rechute
•Médiane (mois) 9,9 (8-15,1)
•Taux à 1 an 44 %
Survie globale
•Médiane (mois) Non atteinte
•Taux à 1 an 64 %
Tableau I. Efficacité de l’association doxorubicine pégylée liposomale + trastuzumab en
première ligne métastatique (5).
1
/
2
100%





![DIUOP Anthracyclines I AERTS FD Oct 15 [Mode de compatibilité]](http://s1.studylibfr.com/store/data/001106971_1-19df66d0a552e6129dd83770295c4cfe-300x300.png)
![DIUOP Anthracyclines I AERTS FD Oct 13 [Mode de compatibilité]](http://s1.studylibfr.com/store/data/004248472_1-ee6480978ae4f06bf6491c1792c676cd-300x300.png)

