Lire l'article complet

228 | La Lettre de l’Infectiologue • Tome XXVIII - no 6 - novembre-décembre 2013
Actualités dans
LE TRAITEMENT DE L’HÉPATITE C
Comment prendre en charge
les événements indésirables
au cours de la trithérapie
contre l’hépatite C ?
Management of side effects during HCV triple therapy
R. Calin*, M.A. Valantin*
L
a prise en charge thérapeutique de l’hépatite C
chronique a radicalement changé, avec l’appa-
rition des molécules antivirales à action directe
(DAA) telles que les inhibiteurs de protéase comme
le bocéprévir et le télaprévir, premiers représentants
de cette classe, destinés uniquement aux patients
infectés par le génotype 1 du virus de l’hépatite C.
De nombreux effets indésirables, en particulier
hématologiques et cutanés, rendent la conduite
de ces traitements diffi cile. Cette revue présente
des conseils pratiques pour mieux gérer ces effets
indésirables de façon appropriée et effi cace.
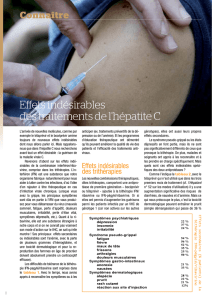
Événements indésirables
avec le bocéprévir
Dans les essais cliniques évaluant le bocéprévir,
en comparaison avec la bithérapie interféron
pégylé + ribavirine, les événements indésirables
les plus notables sont l’anémie, la neutropénie et la
dysgueusie. Parmi 1 225 patients naïfs de traitement
anti-VHC et ayant reçu du bocéprévir dans les essais
d’enregistrement, un taux d’hémoglobine inférieur
à 10 g/dl a été observé chez 50 % d’entre eux, une
neutropénie chez 25 %, et une dysgueusie chez
35 %, versus 30 %, 19 % et 16 % respectivement
chez les patients traités par interféron pégylé +
ribavirine (1).
Dans les études SPRINT-1 et SPRINT-2 (qui
s’adressaient à des patients naïfs) et dans l’étude
RESPOND-2 (patients prétraités), 13 % des patients
inclus dans le bras bocéprévir ont interrompu le trai-
tement anti-VHC en raison d’événements indési-
rables (2-4). Dans l’essai RESPOND-2, le taux
d’anémie observé était de 45 % avec le bocéprévir
versus 20 % chez les patients recevant interféron
pégylé + ribavirine (4). Chez ceux n’ayant jamais reçu
de traitement anti-VHC, l’anémie a été rapportée
chez 49 % des patients traités par bocéprévir contre
29 % dans le groupe de référence (5), et l’ampleur
de l’anémie a nécessité des réductions de posologie
chez 21 % des patients du groupe trithérapie contre
13 % de ceux du groupe contrôle.
Dans ces différentes études, la gestion de l’anémie a
consisté soit en une réduction de la posologie de la
ribavirine, soit en une prescription d’érythropoïétine,
soit en la combinaison des 2 mesures. Chez 39 %
des patients recevant le bocéprévir et 24 % de ceux
traités par interféron pégylé + ribavirine, un ajuste-
ment posologique de la ribavirine ou de l’interféron
a été effectué. La prescription d’érythropoïétine a
été recensée chez près de 43 % des patients traités
par bocéprévir, et 3 % des patients ont eu une trans-
fusion sanguine.
Enfi n, le taux de dysgueusie était de 44 % dans le
bras bocéprévir et de 11 % chez les patients recevant
interféron pégylé + ribavirine.
Événements indésirables
avec le télaprévir
Sous télaprévir, les effets secondaires les plus
fréquents sont les symptômes cutanés et anorec-
taux ainsi que l’anémie. Dans les études cliniques
* Inserm U943, Épidémiologie, stra-
tégies thérapeutiques et virologie
cliniques dans l’infection à VIH ;
service des maladies infectieuses et
tropicales, AP-HP, hôpital de la Pitié-
Salpêtrière, Paris.
R. Calin

La Lettre de l’Infectiologue • Tome XXVIII - no 6 - novembre-décembre 2013 | 229
Points forts
d’enregistrement, ces événements indésirables sont
proportionnellement plus fréquents avec le télaprévir
qu’avec l’association interféron pégylé + ribavirine :
56 % et 34 % pour les manifestations cutanées ;
36 % et 17 % pour l’anémie ; 47 % et 28 % pour le
prurit ; 29 % et 7 % pour les symptômes anorec-
taux, respectivement (1). Dans les études ADVANCE
(patients naïfs) et REALIZE (patient prétraités), le
taux d’interruption du traitement anti-VHC pour
événement indésirable se situait entre 10 et 15 %
respectivement chez les patients recevant le téla-
prévir (versus 7 % et 3 % respectivement dans le
bras interféron pégylé + ribavirine) [6, 7].
De même, les interruptions de traitement pour érup-
tion cutanée chez les patients recevant le télaprévir
ont été retrouvées dans ces mêmes essais chez 5 à
7 % des patients. Quant aux arrêts de traitement
pour motif hématologique, ils se situaient dans le
groupe télaprévir entre 2 et 4 % selon les études.
Les modifi cations de posologie de la ribavirine pour
anémie ont été plus fréquente chez les patients
traités par télaprévir (32 %) que chez les patients
recevant interféron pégylé + ribavirine (12 %). Dans
l’étude ADVANCE, l’anémie a été rapportée chez
37 % des patients du groupe trithérapie contre 19 %
de ceux du groupe témoin (6).
Dans ces mêmes études évaluant le télaprévir,
l’utilisation de l’érythropoïétine était interdite, et
la toxicité hématologique – en particulier l’anémie –
a été gérée par des réductions de posologie de la
ribavirine. Dans une analyse poolée des patients
ayant participé aux essais ADVANCE et ILLUMINATE,
une transfusion sanguine a été pratiquée chez 12 %
des patients qui présentaient un taux d’hémoglo-
bine inférieur à 10 g/dl (5 % des patients du bras
contrôle ; 5/92) [6, 8]. Dans la même analyse, la
modifi cation de la posologie de ribavirine (réduction
ou interruption) n’a pas été associée à des taux plus
faibles de réponse virologique soutenue (RVS) chez
les patients recevant le télaprévir (7).
Les manifestations cutanées sont susceptibles
d’apparaître dans les 4 premières semaines de trai-
tement, mais elles peuvent également survenir à
tout moment. Dans plus de 50 % des cas, elles appa-
raissent au cours du premier mois de traitement.
De rares cas de réactions cutanées graves, parmi
lesquelles une éruption cutanée avec éosinophilie et
symptômes systémiques (Drug Reaction with Eosino-
philia and Systemic Symptoms, DRESS) et le syndrome
de Stevens-Johnson, ont également été décrits avec le
télaprévir. Dans l’étude REALIZE, ces manifestations
cutanées ont été considérées comme graves dans
5 % des cas et ont motivé l’arrêt du télaprévir dans
2 % des cas (7). Des taux équivalents sont retrouvés
dans l’étude ADVANCE, qui recense un syndrome de
Stevens-Johnson 11 semaines après la dernière prise
de télaprévir (6). Dans la cohorte CUPIC, une érup-
tion cutanée sévère (de grade 3/4) est survenue chez
4,8 % des patients traités avec le télaprévir (9, 10).
Aux États-Unis, depuis la commercialisation du téla-
prévir, 92 cas de DRESS et 20 cas de syndrome de
Stevens-Johnson ont été recensés entre mai 2011 et
juin 2012. Par ailleurs, quelques cas de syndrome de
Lyell ont été rapportés au Japon et aux États-Unis ;
parmi ces cas sévères, 2 décès ont été signalés (11).
Bocéprévir et télaprévir
chez les patients cirrhotiques
(CUPIC)
De même que les bithérapies, les trithérapies sont
associées à des effets indésirables plus fréquents
et plus graves chez les patients cirrhotiques que
chez les patients non cirrhotiques. L’étude française
multicentrique CUPIC (9, 10) apporte des donnés
importantes issues de la vie réelle, chez des patients
cirrhotiques traités soit par télaprévir (n = 292), soit
par bocéprévir (n = 205). Bien que l’étude soit non
randomisée, certaines tendances se dégagent de
l’ensemble de ces données. Le profi l de tolérance de
ces 2 molécules dans cette population est médiocre,
comme en témoigne la fréquence élevée d’effets
indésirables graves recensés (45,2 % dans le bras
télaprévir et 32,7 % dans le bras bocéprévir). Le taux
de décès est de 1,7 % chez les patients recevant le
télaprévir et de 0,5 % chez les patients recevant le
bocéprévir, les infections de grade 3/4 sont estimées
à 6,5 % et 2,4 % respectivement, et les cas de décom-
pensation hépatique sont de 2 % et 2,9 % (9, 10).
Les auteurs rapportent également un taux global
d’abandon du traitement de 22,6 % chez les patients
recevant le télaprévir et de 26,3 % chez ceux recevant
»
Dans les essais cliniques évaluant le bocéprévir et le télaprévir, en comparaison avec la bithérapie inter-
féron pégylé + ribavirine, les événements indésirables les plus notables sont hématologiques et cutanés.
»
L’analyse rétrospective des études de phase III du bocéprévir et du télaprévir montre que la diminution
de dose de la ribavirine ne semble pas avoir un impact négatif sur la réponse virologique soutenue, surtout
quand elle intervient après obtention de l’indétectabilité.
»
Le profil de tolérance de ces molécules dans cette population est médiocre, comme en témoigne la
fréquence élevée des effets indésirables graves. Les patients cirrhotiques peuvent être traités, mais avec
prudence et avec un suivi attentif.
»Les patients prétraités ayant une cirrhose compensée mais combinant une numération plaquettaire infé-
rieure à 100 000/mm3 et une albumine sérique inférieure à 35 g/l ont un risque élevé de complications graves.
Mots-clés
Bocéprévir
Télaprévir
Molécules antivirales
à action directe
Événements
indésirables
Highlights
»
In clinical trials evaluating
boceprevir and telaprevir, the
most notable adverse events,
when compared to pegylated
interferon and ribavirin therapy,
were hematologic and cuta-
neous.
»
Retrospective phase III
studies of boceprevir and
telaprevir showed that ribavirin
dose reduction does not seem
to have a negative impact on
SVR, especially after reaching
undetectability.
»
The safety profile of
boceprevir and telaprevir in
cirrhotic patients is poor, as
evidenced by a higher rate
of reported serious adverse
events. Cirrhotic patients
should be treated with caution
and followed attentively.
»
Pretreated patients with
compensated cirrhosis, but
combining a platelet count less
than 100,000/mm3and serum
albumin less than 35g/l are
at high risk of serious adverse
events.
Keywords
Boceprevir
Telaprevir
Direct acting agents
Adverse events

230 | La Lettre de l’Infectiologue • Tome XXVIII - no 6 - novembre-décembre 2013
Comment prendre en charge les événements indésirables
au cours de la trithérapie contre l’hépatiteC ?
Actualités dans
LE TRAITEMENT DE L’HÉPATITE C
le bocéprévir. Les arrêts prématurés causés par ces
effets indésirables étaient de 14,7 % pour le télaprévir
et de 7,3 % pour le bocéprévir. Il est à noter que ces
complications graves n’avaient pas été rapportées
précédemment chez les patients cirrhotiques traités
et antérieurement inclus dans les essais cliniques de
phase III, une des explications étant le fait qu’une
partie importante des sujets de la cohorte CUPIC
présentait une maladie hépatique plus avancée.
Dans l’analyse multivariée, les 2 facteurs prédic-
tifs de complications graves étaient un niveau de
plaquettes inférieur à 100 000/mm3 et une albu-
mine sérique inférieure à 35 g/l. La combinaison
des 2 facteurs a permis de défi nir un sous-groupe
de patients (34/429, soit 8 %) présentant un risque
élevé (44 %) de complications graves. Chez les autres
patients (92,1 %), le risque était plus faible (7 %),
suggérant la possibilité d’un traitement anti-VHC
avec télaprévir et bocéprévir.
Malgré l’utilisation fréquente de l’érythropoïétine
dans l’étude CUPIC (54 % avec le télaprévir et
46 % avec le bocéprévir au cours des 16 premières
semaines de trithérapie), l’incidence de l’anémie
sévère (hémoglobine < 8g/dl) était élevée – aux
alentours de 10 % dans les 2 bras – et sa gestion a
été exceptionnellement diffi cile, conduisant à une
fréquence élevée de transfusions sanguines (16 %
des cas avec le télaprévir et 6 % avec le bocéprévir).
Les facteurs prédictifs indépendants liés à l’anémie
(Hb < 8 g/dl) ou à une transfusion sanguine étaient
le sexe féminin, l’âge supérieur à 65 ans, l’absence de
phase d’induction, et un faible niveau d’hémoglobine
lors de l’instauration du traitement.
Les résultats de l’étude CUPIC ont été confi rmés
par une étude autrichienne menée également chez
des patients atteints de fi brose sévère (F3-F4), qui
montre qu’un taux d’albumine inférieur à 35 g/l est
un facteur prédictif signifi catif de survenue d’une
infection grave au cours d’un traitement par la
trithérapie (12).
Gestion des événements
indésirables
Effets indésirables hématologiques
Dans les grands essais d’enregistrement, l’anémie
a été reconnue comme l’un des effets indésirables
majeurs du bocéprévir et du télaprévir. L’anémie,
marqueur d’effi cacité virologique dans le traitement
par interféron pégylé + ribavirine, est discutée dans
les associations utilisant le bocéprévir. Ce lien, en
revanche, ne semble pas s’appliquer au traitement
par télaprévir (13). L’analyse de l’essai SPRINT-2
indique que la RVS est plus élevée chez les patients
traités par bocéprévir qui développent une anémie.
La gestion de l’anémie était laissée au choix des
investigateurs : érythropoïétine sans baisse de la
ribavirine (38 %), baisse de la ribavirine sans utili-
sation d’érythropoïétine (8 %), baisse de la ribavi-
rine et utilisation d’ érythropoïétine (40 %), ou ni
l’un ni l’autre (14 %). Le taux de RVS était de 58 %
chez les patients traités par bocéprévir et n’ayant
pas présenté d’anémie, et de 70 % chez ceux pour
lesquels une baisse du taux d’hémoglobine a été
observée (5). Par ailleurs, les taux de RVS étaient de
74 % pour les patients ayant reçu l’érythro poïétine,
de 72 % pour ceux dont la dose de ribavirine avait
été réduite, et de 70 % pour ceux qui avaient reçu
l’érythropoïétine et dont la dose de ribavirine avait
été réduite. Cette même tendance a été observée
dans l’étude RESPOND-2 (4). Dans une étude
récente publiée par Zeuzem et al. (14), évaluant
l’impact d’une baisse de la dose de ribavirine chez les
patients traités par télaprévir, l’analyse multivariée
mettait en évidence une association signifi cative
entre l’anémie et le taux d’hémoglobine à l’instaura-
tion du traitement (OR = 1,63), la dose de ribavirine
(OR = 1,25 par mg/ kg), l’âge (OR = 1,67 par décennie)
et la présence d’une cirrhose (OR = 1,76). Dans cette
même étude, la dose de ribavirine a été diminuée
chez 43 % des patients après une durée médiane de
traitement de 9 semaines ; pour 48 % d’entre eux,
la dose a été diminuée à une posologie inférieure
à 600 mg/jour. Cette réduction de dose touchait
un nombre équivalent de patients présentant ou
non une cirrhose. Dans le suivi de cette réduction
de la dose de ribavirine, près de 72 % des patients
n’ont pas eu à subir de nouvelle intervention ; en
revanche, 9 % d’entre eux ont dû recourir à l’érythro-
poïétine ou à une transfusion (plus fréquemment
chez les patients cirrhotiques). Pour l’ensemble de
ces patients, la modifi cation de la dose de ribavirine
n’a pas entraîné de réduction de la probabilité de
RVS (OR = 1,59 ; IC95 : 1,08-2,35). Enfi n, l’analyse
rétrospective des études de phase III du bocéprévir
et du télaprévir montre que la diminution de la dose
de ribavirine ne semble pas avoir d’impact négatif
sur la RVS.
Un des points importants abordés dans la gestion de
l’anémie chez les patients recevant soit le bocéprévir
soit le télaprévir concerne le lien entre séquence
thérapeutique et réduction de la dose de ribavirine.
Dans l’essai SPRINT-2, le moment choisi pour la
réduction de dose semble corrélé aux taux de RVS (5).

La Lettre de l’Infectiologue • Tome XXVIII - no 6 - novembre-décembre 2013 | 231
Actualités dans
LE TRAITEMENT DE L’HÉPATITE C
Ainsi, parmi les 145 patients ayant à la fois eu une
réduction de dose et reçu de l’érythropoïétine, les
taux de RVS ont été de 44 % (4/9) lorsque la dose
de ribavirine était réduite avant la 4
e
semaine de
traitement, 62 % (31/50) lorsque la dose était réduite
entre S4 et S8, 76 % (32/42) lorsque la dose était
réduite entre S8 et S12, 71 % (12/17) lorsque la dose
était réduite entre S12 et S16, et 85 % (22/26) lorsque
la dose était réduite à partir de la 16e semaine. Ces
premières analyses doivent être pondérées par
les résultats des études rétrospectives de grandes
séries de patients traités par la bithérapie interféron
pégylé + ribavirine. Ces études montrent que la dimi-
nution de la dose de ribavirine a un impact négatif
sur la RVS uniquement lorsque la dose cumulée est
inférieure à 60 % de la dose prévue.
Dans le cadre de la bithérapie, l’érythropoïétine
permet de maintenir plus souvent la pleine dose
de ribavirine, tout en conservant la qualité de vie
des patients. L’utilisation de cette molécule chez le
patient infecté par le VHC est une pratique accep-
table hors AMM, sous réserve de limiter strictement
cet usage aux patients ayant une concentration
d’hémoglobine inférieure à 10 g/dl. Malgré l’ab-
sence de recherche de dose, la dose de 30 000 UI
par semaine par voie sous-cutanée est recommandée
par la Haute Autorité de santé (HAS). Cette dose
initiale de 30 000 UI par semaine sera adaptée à
partir de la 2
e
semaine en fonction du taux d’hémo-
globine. Il est nécessaire de surveiller régulièrement
la réponse au traitement afi n de diminuer les doses
d’érythropoïétine (de 25 à 50 %) si le taux d’hémo-
globine augmente trop rapidement (plus de 1 g/dl
en 2 semaines ou plus de 2 g/dl en 4 semaines),
voire d’arrêter le traitement si le taux d’hémoglobine
atteint le seuil de 12 g/dl, un taux supérieur pouvant
exposer à un risque de thrombose (15).
L’effet positif de l’érythropoïétine associée aux
trithérapies anti-VHC n’a pas encore été démontré.
Concernant le bocéprévir, la stratégie consistant à
diminuer en première intention la dose de ribavirine
versus l’utilisation de l’érythropoïétine a été évaluée
dans un essai prospectif randomisé (5). Le taux de
RVS était similaire dans les 2 bras, quel que soit le
moment de la survenue de l’anémie, y compris lors
de la phase d’induction par bithérapie.
Se fondant sur les résultats de cette étude, la
Société de pathologie infectieuse de langue fran-
çaise (SPILF) et l’Association française pour l’étude
du foie (AFEF) recommandent, lors des trithérapies
anti-VHC comportant du bocéprévir ou du télaprévir,
d’envisager en première intention une réduction de
la dose de ribavirine de 200 à 400 mg/jour en cas
d’anémie avec un taux d’hémoglobine inférieur à
10 g/dl ou en cas de diminution de plus de 2 g/ dl
en 15 jours, même si la charge virale n’est pas stric-
tement indétectable (16, 17). Les diminutions ulté-
rieures sont réalisées par paliers de 200 mg. Il n’est
pas recommandé de diminuer la dose initiale de plus
de 50 %. L’érythropoïétine peut être utilisée lors
d’une deuxième étape. Dans tous les cas, la dose de
télaprévir ou de bocéprévir ne doit pas être modifi ée.
Les recommandations sont plus nuancées pour les
patients cirrhotiques, car les données sont insuffi -
santes pour recommander l’une ou l’autre de ces
stratégies. Dans cette situation, le maintien de la
dose de ribavirine, au moins pendant la période de
détectabilité de l’ARN-VHC, et le recours d’emblée
à l’érythropoïétine sont recommandés.
Les neutropénies induites par l’interféron pégylé sont
fréquentes ; elles fl uctuent de 14 à 24 % selon les
essais les plus récents et représentent une cause de
réduction de dose de l’interféron (2, 3, 18). Le résumé
des caractéristiques du produit (RCP) de l’interféron
pégylé recommande une réduction de dose lorsque
le nombre de polynucléaires neutrophiles devient
inférieur à 750/mm
3
. Chez les patients ayant un
nombre absolu de polynucléaires neutrophiles infé-
rieur à 500/mm
3
, le traitement doit être suspendu
jusqu’à ce que le nombre absolu de polynucléaires
neutrophiles redevienne supérieur à 1 000/mm3. L’uti-
lisation des facteurs de croissance granulocytaires
dans la neutropénie induite par l’interféron ne fait
pas partie des indications de l’AMM de ces produits.
Ils peuvent néanmoins constituer un recours dans
certaines circonstances : pour augmenter le taux de
neutrophiles, pour réduire l’incidence des épisodes
infectieux et permettre une prolongation du traite-
ment. Ces facteurs de croissance sont de plus en plus
utilisés par les équipes qui ont à prendre en charge
ces patients. Certains centres experts dans la prise
en charge de l’hépatite C proposent de maintenir la
pleine dose d’interféron pégylé en cas de neutropénie
comprise entre 500 et 750/mm3 (sous couvert d’une
surveillance hebdomadaire de la NFS) et d’utiliser
des facteurs de croissance granulocytaires en cas de
neutropénie inférieure à 500/mm3. Dans la cohorte
CUPIC, la neutropénie est estimée à 2,7 % avec le
télaprévir et à 4,8 % avec le bocéprévir ; les facteurs de
croissance granulocytaires ont été utilisés chez 2,4 %
et 4,4 % des patients respectivement (10).
La thrombopénie est un autre effet indésirable
observé avec l’administration d’interféron. Dans la
cohorte CUPIC, 12,6 % des patients traités par téla-
prévir et 6,4 % des patients traités par bocéprévir ont
développé ce type de toxicité. Cette thrombopénie

232 | La Lettre de l’Infectiologue • Tome XXVIII - no 6 - novembre-décembre 2013
Comment prendre en charge les événements indésirables
au cours de la trithérapie contre l’hépatiteC ?
Actualités dans
LE TRAITEMENT DE L’HÉPATITE C
nécessite parfois une réduction de dose ou un arrêt du
traitement (30 % dans CUPIC). Le RCP de l’interféron
pégylé recommande une réduction de dose en cas de
diminution du nombre des plaquettes au-dessous de
50 000/mm3 (sous couvert d’une surveillance hebdo-
madaire de la NFS), voire l’arrêt du traitement si la
thrombopénie est inférieure à 25 000/mm
3
. À ce jour,
les produits stimulants de la thrombopoïèse comme
le romiplostim n’ont pas d’indication dans la throm-
bopénie induite par l’interféron ; cependant, l’utilisa-
tion de ce type de produit est rapportée chez 1,4 %
des patients, toujours dans la cohorte CUPIC (10).
Effets indésirables cutanéo-muqueux
Le spectre des manifestations dermatologiques
décrit avec le traitement anti-VHC va du prurit
cutané avec ou sans urticaire aux éruptions eczé-
matiformes, pour la majorité limitées mais pouvant
être graves. Compte tenu de la fréquence des mani-
festations cutanées chez les patients sous télaprévir,
l’AFEF a publié des recommandations sur la gestion
de ces effets secondaires (16, 17) :
➤
en présence d’une dermatite eczématiforme
localisée avec ou sans prurit de grade 1 (localisée),
le traitement par télaprévir peut être maintenu. Le
traitement symptomatique comporte émollients
cutanés et dermocorticoïdes. L’avis du dermatologue
n’est pas indispensable (tableau I) ;
➤
en présence d’une dermatite eczématiforme
de grade 2 (diffuse, moins de 50 % de la surface
cutanée), le traitement par télaprévir peut être
maintenu après avis du dermatologue, qui assure
un suivi régulier ;
➤
la présence d’une éruption sévère de grade 3
correspondant à une atteinte diffuse supérieure à
50 % de la surface cutanée, marquée par une exten-
sion de l’éruption ou l’apparition d’autres signes
cutanés ou généraux (fi èvre, nausées, diarrhées,
ulcères buccaux, œdème facial, yeux rouges, hépa-
tite) avec ou sans éosinophilie doit faire arrêter les
3 composants de la trithérapie ;
➤
la suspicion de syndrome de Stevens-Johnson ou
de DRESS – grade 4 – doit conduire à l’arrêt immédiat
et défi nitif de tous les traitements, et le patient doit
être hospitalisé.
Le mécanisme du prurit anal sous télaprévir est
mal connu, mais sa fréquence peut être élevée. On
pourra proposer l’application de dermocorticoïdes
ou d’émollients et l’utilisation d’antihistaminiques.
Enfi n, l’altération du goût semble être une constante
des effets secondaires chez les patients traités avec
Tableau I. Manifestations cutanées (AFEF-SPILF 2013).
Grade Type d’éruption Arrêt du télaprévir Conduite à tenir
Grade 1 Localisée et/ou distribution limitée
(jusqu’à plusieurs endroits isolés
ducorps)
Généralement non nécessaire Suivi de l’aggravation ou de l’appa-
rition de symptômes systémiques
jusqu’à disparition de l’éruption
cutanée
Grade 2 Diffuse, atteignant jusqu’à 50 %
dela surface corporelle
Généralement non nécessaire, mais :
• arrêt définitif du télaprévir si
extension à J7 en l’absence d’amé-
lioration ou
• arrêt de la ribavirine en cas
d’aggra vation
Suivi de l’aggravation ou de l’appa-
rition de symptômes systémiques
jusqu’à disparition de l’éruption
cutanée
Consultation de dermatologie
recommandée
Grade 3 > 50 % de la surface corporelle
et/ou associée à :
• des symptômes systémiques
• une ulcération des muqueuses
• des lésions en cocarde
• un décollement de l’épiderme
Arrêt des 3 composants de la trithé-
rapie (recommandation FDA)
Consultation de dermatologie forte-
ment recommandée
Suivi de la disparition des symp-
tômes systémiques jusqu’à dispari-
tion de l’éruption
Grade 4 Suspicion ou diagnostic :
• d’une éruption bulleuse généra-
lisée
• d’un DRESS
• d’un syndrome de Stevens-Johnson/
nécrolyse épidermique toxique
• d’une pustulose exanthématique
aiguë généralisée
• d’un érythème polymorphe
Arrêt immédiat et défi nitif de tous
les traitements
Hospitalisation
 6
6
 7
7
1
/
7
100%