1 - FICHE DE RENSEIGNEMENTS SUR VICTRELIS

FICHE DE RENSEIGNEMENTS SUR VICTRELIS™ (BOCÉPRÉVIR)
QU’EST-CE QUE VICTRELIS™?
VICTRELIS™ est un nouveau traitement oral contre l’infection chronique par le virus de l’hépatite C
(VHC). Le bocéprévir est le premier agent d’une nouvelle classe de médicaments, appelée inhibiteurs
de la protéase du VHC. Il est utilisé en association avec le traitement standard actuel, soit l’interféron
alpha péguylé et la ribavirine, qui est disponible au Canada sous le nom de PEGETRON® ou de
PEGASYS®. Comme il s’agit d’un agent antiviral à action directe, le bocéprévir s’attaque au virus lui-
même, à la différence du traitement standard actuel (interféron alpha péguylé et ribavirine) qui
renforce le système immunitaire pour susciter une réponse.
INDICATION
Le bocéprévir est indiqué pour le traitement de l’infection chronique par le génotype 1 du VHC, en
association avec l’interféron alpha péguylé et la ribavirine, chez les adultes (18 ans et plus) atteints
d’une hépatopathie compensée, y compris une cirrhose, qui n’ont jamais été traités ou qui ont déjà
connu un échec thérapeutique.
1
EFFICACITÉ ÉPROUVÉE
Deux études pivots, SPRINT-2 et RESPOND-2, ont démontré que l’ajout de VICTRELIS™ au traitement
standard (interféron alfa-2b péguylé et ribavirine) s’est traduit par une augmentation significative du
nombre de patients qui ont éliminé le virus, par rapport au traitement standard administré seul.
2
,
3
Au total, 1 500 patients ont participé à ces deux études cliniques, dont près de 10 % (146) recrutés
dans 15 centres d’étude canadiens. Dans les deux études, les patients ont été divisés aléatoirement en
trois groupes de traitement:
Le groupe ayant reçu un traitement axé sur la réponse (TAR), dans lequel les patients ont reçu
seulement l'association d’interféron alfa-2b péguylé et de ribavirine pendant les quatre
premières semaines, puis ces deux médicaments plus du bocéprévir. La durée totale du
traitement était déterminée par des critères de réponse précoce précis. Les patients ayant déjà
connu un échec thérapeutique, qui présentaient une charge virale (ARN du VHC) indétectable
après 8 et 12 semaines, ont cessé tout traitement après 36 semaines
4
. Les patients n’ayant jamais
été traités auparavant, qui présentaient une charge virale (ARN du VHC) indétectable de la 8e à la
24e semaine, ont cessé tout traitement après 28 semaines.
5
Le groupe ayant reçu un traitement de 48 semaines, dans lequel les patients ont reçu
l’interféron alfa-2b péguylé et la ribavirine pendant les quatre premières semaines, puis ces deux
médicaments plus du bocéprévir pendant 44 autres semaines.
6
,
7
Le groupe témoin, dans lequel les patients ont reçu le traitement standard, soit l'association
d’interféron alfa-2b péguylé et de ribavirine pendant 48 semaines.
8
,
9

- 2 -
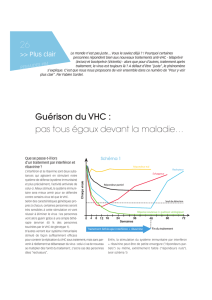
Dans l’étude RESPOND-2 (patients ayant déjà connu un échec thérapeutique), l’ajout du bocéprévir
dans le groupe de traitement de 48 semaines et dans le groupe de TAR a permis à respectivement 66 %
et à 59 % des patients d’éliminer le virus, comparativement à 21 % dans le groupe témoin (p < 0,001).
10
Dans le groupe de TAR, 86 % des patients qui présentaient une réponse précoce
11
– définie comme un
ARN du VHC indétectable après 8 et 12 semaines – ont éliminé le virus et ont cessé le traitement après
36 semaines, soit une réduction de 12 semaines du traitement.
12
Dans l’étude SPRINT-2 (patients n’ayant jamais été traités), l’ajout du bocéprévir dans le groupe de
traitement de 48 semaines et dans le groupe de TAR a permis à respectivement 66 % et à 63 % des
patients d’éliminer le virus, comparativement à 38 % dans le groupe témoin (p < 0,001).
13
Dans le
groupe de TAR, 96 % des patients qui présentaient une réponse précoce
14
– définie comme un ARN du
VHC indétectable de la 8e à la 24e semaine
15
– ont éliminé le virus et ont cessé le traitement après
28 semaines, soit une réduction de 20 semaines du traitement.
16
PROFIL DE TOLÉRANCE
Chez les patients ayant connu un échec thérapeutique
Dans l’étude RESPOND-2, les cinq effets indésirables reliés au traitement les plus fréquemment
rapportés dans chacun des trois groupes d’étude – le groupe de TAR recevant du bocéprévir, le groupe
de traitement de 48 semaines recevant du bocéprévir et le groupe témoin – ont été : fatigue,
céphalées, nausées, anémie et frissons. Des effets indésirables graves ont été rapportés chez 10 %,
14 % et 5 % des patients, respectivement.
Patients n’ayant jamais été traités
Dans l’étude SPRINT-2, les cinq effets indésirables reliés au traitement les plus fréquemment rapportés
dans chacun des trois groupes d’étude – le groupe de TAR recevant du bocéprévir, le groupe de
traitement de 48 semaines recevant du bocéprévir et le groupe témoin – ont été : fatigue, céphalées,
nausées, anémie et dysgueusie (mauvais goût). Des effets indésirables graves ont été rapportés chez
11 %, 12 % et 9 % des patients, respectivement.
Dans les deux études, les taux d’abandon en raison d’effets indésirables ont été de 13 % dans les
groupes recevant du bocéprévir et de 12 % dans les groupes témoins.
POSOLOGIE
La dose recommandée de bocéprévir est de 800 mg (quatre capsules de 200 mg) prise par voie orale
trois fois par jour (à intervalles de sept à neuf heures) avec des aliments (avec un repas ou une
collation).
Le bocéprévir ne doit pas être administré en monothérapie. Il ne doit être administré qu’en association
avec l’interféron alpha péguylé et la ribavirine.
DISPONIBILITÉ
VICTRELIS™ (bocéprévir) est maintenant disponible au Canada. Le coût est fonction de la durée du
traitement.

- 3 -
Le prix de vente de VICTRELIS™ est 1 050 $ par semaine.
VICTRELIS™ est une marque de commerce de Schering Corp., filiale de Merck & Co., Inc.
PEGETRON® est une marque déposée de Schering Corp., filiale de Merck & Co., Inc.
PEGASYS® est une marque déposée de Hoffmann-La Roche Limitée.
Références:
1
Monographie de VICTRELISTM, 27 juillet 2011, p. 3.
2
Poordad, F. et coll. pour les investigateurs de l’étude SPRINT-2, « Boceprevir for Untreated Chronic HCV Genotype 1
Infection », N Engl J Med, 364, 2011, p. 1195-1206, p. 1195.
3
Bacon, B.R. et coll. pour les investigateurs de l’étude RESPOND-2 sur le VHC, « Boceprevir for Previously Treated Chronic
HCV Genotype 1 Infection », N Engl J Med, 364, 2011, p. 1207-1217, p. 1207.
4
Ibid., p. 1209.
5
Poordad, F. et coll. pour les investigateurs de l’étude SPRINT-2, « Boceprevir for Untreated Chronic HCV Genotype 1
Infection », N Engl J Med, 364, 2011, p. 1195-1206, p. 1197.
6
Ibid., p. 1197.
7
Bacon, B.R. et coll. pour les investigateurs de l’étude RESPOND-2 sur le VHC, « Boceprevir for Previously Treated Chronic
HCV Genotype 1 Infection », N Engl J Med, 364, 2011, p. 1207-1217, p. 1207.
8
Ibid.
9
Poordad, F. et coll. pour les investigateurs de l’étude SPRINT-2, « Boceprevir for Untreated Chronic HCV Genotype 1
Infection », N Engl J Med, 364, 2011, p. 1195-1206, p. 1197.
10
Bacon, B.R. et coll. pour les investigateurs de l’étude RESPOND-2 sur le VHC, « Boceprevir for Previously Treated Chronic
HCV Genotype 1 Infection », N Engl J Med, 364, 2011, p. 1207-1217, p. 1207.
11
Ibid.
12
Ibid., p. 1209.
13
Poordad, F. et coll. pour les investigateurs de l’étude SPRINT-2, « Boceprevir for Untreated Chronic HCV Genotype 1
Infection », N Engl J Med, 364, 2011, p. 1195-1206, p. 1200-1201.
14
Ibid., p. 1201.
15
Ibid., p. 1200.
16
Ibid., p. 1197.
1
/
3
100%