L Surveillance après traitement du cancer du sein : d

La Lettre du Gynécologue - n° 325 - octobre 2007
Dossier
Dossier
18
Surveillance après traitement du cancer du sein :
ni trop ni trop peu
Follow up after the treatment of breast cancer: nothing or intensive strategy?
IP E. Sebban*
* Institut du sein Henri-Hartmann, clinique Hartmann, 26, bd Victor-Hugo, 92200 Neuilly-
sur-Seine.
La surveillance du cancer du sein traité est le motif de
consultation le plus fréquent en oncologie. En effet, plus
de 40 000 femmes sont atteintes tous les ans et ce chiffre
ne fait qu’augmenter. De plus, la surveillance doit être prolongée
à cause des récidives tardives. Malheureusement, ce sujet ne pas-
sionne personne et c’est un peu le parent pauvre de l’oncologie.
De nombreuses questions se posent au sujet de la surveillance
des cancers du seins traités :
Faut-il surveiller les patientes ?
Pourquoi les surveiller ?
Y a-t-il un bénéfice en termes de survie sans récidive ou de
survie globale ?
Comment assurer cette surveillance ?
Que faut-il surveiller ?
Par qui l’assurer ?
Telles sont les questions qui se posent actuellement aux pra-
ticiens qui ont en charge, pendant de nombreuses années, les
patientes traitées pour un cancer du sein. La survie globale
n’est cependant pas le seul critère de jugement et la qualité de
vie, par exemple, est tout aussi importante.
PROBLÉMATIQUE
Sachant que la surveillance est lourde sur le plan économique
et psychologique, tout le problème est de savoir si dépister au
plus tôt les récidives locorégionales ou les métastases apporte
un bénéfice à la patiente et justifie les contraintes qu’elle occa-
sionne ainsi que les nombreux examens complémentaires de
surveillance. Mais la survie n’est pas le seul paramètre de juge-
ment : la qualité de vie est un critère tout aussi important. De
plus, les patientes sont très demandeuses d’une surveillance
qui leur permettra, en cas de normalité de l’examen, de retrou-
ver une quiétude psychologique. Il sera aussi nécessaire de
leur faire comprendre que normalité de l’examen ne veut pas
dire absence de récidive.
OBJECTIFS DE LA SURVEILLANCE
Les objectifs de la surveillance des cancers du sein se justifient
par leur évolution potentielle :
50 % des patientes récidiveront dans les dix ans, les trois
quarts du temps sous forme métastatique et dans le quart res-
tant sous forme d’une récidive locorégionale (3).
La majorité de ces récidives surviennent dans les cinq ans
(dans 80 % des cas), mais la rechute à long terme est possible,
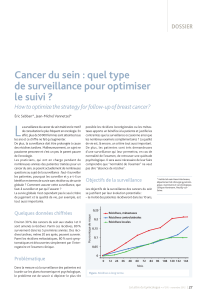
même après dix ans (figure 1).
Les patientes revendiquent une surveilllance intensive en
espérant un diagnostic anticipé, qui serait donc de meilleur
pronostic.
De plus, il paraît nécessaire d’évaluer les effets secondaires
possibles des différents traitements (1).
Les médecins doivent prendre en compte :
– les bénéfices réellement obtenus par cette surveillance ;
– la qualité de vie des patientes (QOL : quality of life) ;
– le coût pour la société ;
– les implications psychologiques ;
– les résultats à long terme pour l’évaluation de l’efficacité thé-
rapeutique.
La surveillance est fondée sur :
– le dépistage précoce de la récidive locale ou locorégionale ;
– le dépistage précoce d’un cancer controlatéral ;
– le dépistage d’une récidive métastatique ;
– l’évaluation des résultats : qualité de vie, pronostic fonction-
nel et esthétique ;
– la réinsertion : traitements des complications iatrogènes
et des séquelles liées aux différents traitements, qu’ils soient
Figure.
La majorité des récidives surviennent dans les cinq ans,
mais la rechute à long terme est possible, même après dix ans.

La Lettre du Gynécologue - n° 325 - octobre 2007
Dossier
Dossier
19
chirurgicaux, radiothérapiques, chimiothérapiques, hormo-
naux et autres ; réinsertion socioprofessionnelle et psycholo-
gique (2).
Tableau.
Facteurs prédictifs de récidive locale.
Valeur pronostique
Paramètres cliniques
Jeune âge (< 35 ans)
Patiente non ménopausée
Volume tumoral
+++
++
+
Paramètres histologiques
Grade SBR
Emboles vasculaires
Exérèse non in sano
Importante composante intracanalaire
Taille tumorale
Traitement adjuvant inadapté
+++
++
++
+
+
+++
FIN DES TRAITEMENTS
L’arrêt des traitements est ressenti de façon variable : certai-
nes se sentent soulagées, avec une impression de guérison,
d’autres ont un sentiment d’abandon, avec une peur de la
rechute. Il faut rassurer et aider à la réintégration familiale et
socioprofessionnelle.
Quel équilibre trouver entre l’absence totale de surveillance
demandée par certaines qui se considèrent comme guéries et
une surmédicalisation par d’autres qui vivent dans l’angoisse
de la récidive (tableau) ?
LA SURVEILLANCE ATELLE
UN INTÉRÊT DÉMONTRÉ ?
De nombreuses études rétrospectives ont été publiées à ce
sujet. Pour répondre à cette question, nous évoquerons deux
essais randomisés publiés en 1994 (5, 6), ont essayé de démon-
trer si le suivi intensif avait un intérêt.
L’étude du GIVIO (6) portait sur 1 320 patientes traitées pour
un cancer du sein non métastatique. Les patientes étaient
randomisées en deux groupes, pour l’un il s’agissait d’une
surveillance standard et pour l’autre d’une surveillance inten-
sive, la différence entre les deux étant que dans le groupe du
suivi intensif, un bilan biologique (hépatique), une radiogra-
phie pulmonaire, une scintigraphie osseuse et une échogra-
phie abdominale étaient effectués tous les six mois en plus de
l’examen clinique standard proposé aux deux groupes. Cette
surveillance a duré cinq ans.
La qualité de vie était évaluée à six mois, un, deux et cinq ans.
Les résultats montrent l’absence de différence significative entre
les deux groupes en termes de survie sans récidive, de même
que pour la survie globale. La surveillance intensive n’a permis
d’anticiper que d’un mois le diagnostic de la rechute. Quant à la
qualité de vie, elle était identique dans les deux groupes.
L’étude de Delturco (5) portait, elle, sur 1 243 patientes. La
randomisation proposée était sensiblement identique à l’étude
précédente.
La survie sans récidive s’est révélée être moins bonne dans le
groupe du suivi intensif du fait d’une détection plus précoce
des récidives, mais la survie globale reste identique.
Il semble donc que le rôle essentiel du suivi sera de détecter
les atteintes dites curables, telles que les récidives locorégio-
nales et les cancers du sein controlatéraux, alors que la détec-
tion des métastases a un intérêt limité, compte tenu de leur
mauvais pronostic (conférence de consensus italienne ANON
1995), en sachant que l’arrivée de nouvelles molécules pour-
rait permettre un gain significatif dans l’allongement de la
durée de la survie.
L’ASCO (American Society Of Clinical Oncology) (8) recom-
mande, depuis 1999, de surveiller les patientes en insistant sur
l’interrogatoire et l’examen clinique, avec une visite tous les
quatre mois pendant trois ans, puis tous les six mois pendant
deux ans puis une fois par an. Une mammographie et une
échographie mammaire y seront associées une fois par an. Les
autres examens ne seront pas proposés à titre systématique
(radiographie du thorax, marqueurs, échographie abdomino-
pelvienne, scintigraphie osseuse…) (7).
DONNÉES ÉCONOMIQUES
Une évaluation économique de la stratégie de surveillance
apporte un argument supplémentaire pour ne pas multiplier
les examens inutiles : une équipe lyonnaise (9) a comparé les
coûts de deux modalités de surveillance et retrouve une éco-
nomie allant de 35 à 75 % selon l’année de surveillance, ce qui
est loin d’être négligeable compte tenu de la fréquence du can-
cer du sein.
CAS PARTICULIER DES FORMES HÉRÉDITAIRES
DE CANCER DU SEIN
Les femmes présentant une mutation génétique BRCA 1 ou 2
ou même les patientes sans mutation mais avec des risques
familiaux avérés représentent une situation particulière, car
plus exposées à la récidive dont la récidive controlatérale.
Les signes radiologiques peuvent confirmer une suspicion cli-
nique, dépister une récidive infraclinique ou dépister un can-
cer controlatéral.
L’IRM avec injection de gadolinium prend de plus en plus
d’importance dans ces situations. Elle diminue les faux posi-
tifs, source de réinterventions inutiles, car elle a une bonne
spécificité, proche de 100 %, contrairement à la mammogra-
phie (4). C’est la raison pour laquelle peut être proposée, à titre
systématique, une IRM à trois mois de la fin des traitements
servant de point de repère, puis une IRM annuelle, mais cela
demanderait un parc d’IRM qui n’existe pas encore en France.

La Lettre du Gynécologue - n° 325 - octobre 2007
Dossier
Dossier
20
CONCLUSION
L’objectif de la surveillance du sein traité est de faire le plus
rapidement possible le diagnostic d’une récidive locorégionale
potentiellement curable, ainsi que des cancers controlatéraux
et de la sphère gynécologique. Le suivi repose sur l’examen
clinique et la mammographie qui permettront de diagnosti-
quer la majorité des récidives. Le dépistage des métastases,
même si son intérêt en termes de survie n’est pas démontré,
sera néanmoins proposé, permettant de prévenir des compli-
cations invalidantes en faisant le diagnostic plus précoce des
métastases (fractures pathologiques, compressions médullai-
res…). La surveillance aura aussi comme fonction de dépister
les complications iatrogènes ainsi que les cancers controlaté-
raux ou ceux de la sphère gynécologique (cancer de l’endomè-
tre sous tamoxifène). n
RéféRences bibliogRapihiques
1. Gion M, Mione R, Nascimbend et al. e tumor associated antigen CA 15.3 in
primary breast cancer. Evaluated of 667 cases. Br J Cancer 1991;63:809-13.
2. Dilhuydy JM. Préparer tôt la réinsertion. In: Pujol H, Schraub S, Serin D eds.
Les enjeux de la prise en charge des maladies du cancer. Paris : Flammarion
1997:97-100.
3. Derschaw DD, Mac Cormick B, Osborne MP. Detection of local recurrence
after conservative therapy for breast carcinoma. Cancer 1992;70:493-6.
4. Gilles R, Guinebretière JM, Shapeero LG et al. Assessement of breast cancer
recurrence with contrast-enhanced subtraction MR imaging: preliminary results
in 26 patients. Radiology 1993;188:473-8.
5. Del Turco MR, Palli D, Carridi A et al. Intensive diagnostic follow up after
treatment of primary breast cancer: a randomised trial. JAMA 1994;271:1593-
7.
6. GIVIO. Impact of follow up testing on survival and health-related qua-
lity of life in breast cancer patients. A mulicenter randomised controlled trial.
e GIVIO Investigators. Comment in: ACP J Club 1994;121:76-7. JAMA
1994;271:1587-92.
7. Sebban E. Pour la surveillance intensive après traitement du cancer du sein.
Gynecol Obstet Fertil 2006;34:268-70.
8. American Society Of Clinical Oncology. Update of recommended breast can-
cer surveillance guidelines. J Clin Oncol 1999;17:1080-2.
9. Mille D, Roy T, Carrere MO et al. Economic impact of harmonizing medical
practices : compliance with clinical practice guidelines in the follow up of breast
cancer in a french comprehensive cancer center. J Clin Oncol 2000;18:1718-24.
RHOPHYLAC 200 microgrammes/2 ml, RHOPHYLAC 300 microgrammes/2 ml
Composition : Immunoglobuline humaine anti-D (Rh), solution injectable en seringue préremplie, 2 ml :
• Ig anti-D 1000 UI (200 microgrammes) soit 500 UI (100 microgrammes) par ml. Protéines plasmatiques
humaines
25 mg/ml* • Ig anti-D 1500 UI (300 microgrammes) soit 750 UI (150 microgrammes)
par ml. Protéines plasmatiques humaines
30 mg/ml*
* dont 10 mg/ml d'albumine humaine (stabilisant) et
95 % d'IgG. IgA
5 µg/ml.
Excipients : albumine humaine, glycine, chlorure de sodium, eau ppi.
Indications : Prévention de l’allo-immunisation fœtomaternelle Rh(D) chez les femmes
Rh(D)-négatif : grossesse / accouchement d’un enfant Rh(D)-positif, fausse couche / menace de fausse
couche / grossesse ectopique ou môle hydatiforme, hémorragie transplacentaire secondaire à une
hémorragie pré-partum, amniocentèse, biopsie de villosité choriale ou manœuvres obstétricales,
telles que version céphalique externe ou traumatisme abdominal. Traitement des sujets Rh(D)-
négatif après transfusions incompatibles de sang Rh(D)-positif ou d'autres produits contenant
des hématies Rh(D)-positif. •Posologie* : Respecter les directives professionnelles en vigueur.
Schémas recommandés : Prévention de l’allo-immunisation fœtomaternelle Rh(D) chez les
femmes Rh(D)-négatif • Prophylaxie avant l'accouchement : dose unique de 300 µg (1500 UI) IV
ou IM à 28-30 semaines de grossesse. • Prophylaxie après l'accouchement : 200 µg (1000 UI) IV
ou de 200 µg (1000 UI) à 300 µg (1500 UI) IM. Administrer RHOPHYLAC le plus tôt possible dans
les 72 heures qui suivent l'accouchement. Administrer également la dose postpartum si une
prophylaxie antepartum a été administrée. Si hémorragie fœtomaternelle importante (> 4 ml (0,7 % -
0,8 % des femmes)) soupçonnée (ex. : anémie fœtale, mort fœtale intra-utérine), estimer son
intensité par un test de Kleihauer-Betke : administrer des doses complémentaires d'Ig anti-D à raison
de 20 µg/100 UI par ml d'hématies fœtales.• Prophylaxie après une complication de la grossesse :
- Interventions et incidents 12 semaines de grossesse : 200 µg (1000 UI) IV ou IM. - Interventions
et incidents > 12 semaines de grossesse : au moins 200 µg (1000 UI) IV ou IM. - Prélèvement de villosités
choriales : 200 µg (1000 UI) IV ou IM. Administrer RHOPHYLAC dès que possible, sans dépasser
72 heures après l'événement à risque. Transfusions incompatibles : Dose recommandée : 20 µg
(100 UI) d’Ig anti-D pour 2 ml de sang Rh(D)-positif transfusés ou par ml de concentré érythrocytaire.
Injection IV recommandée. En cas d'injection IM : si les doses sont importantes, les administrer sur
plusieurs jours. Dose maximale de 3000 µg suffisante dans le cas d'importantes transfusions
incompatibles, indépendamment du fait que le volume de transfusion soit > à 300 ml de sang
Rh(D)-positif. Mode d'administration : RHOPHYLAC peut être administré par injection IV ou IM.
En cas de troubles hémorragiques contre-indiquant les injections IM, administrer par voie IV. Si dose
importante (> 5 ml) et voie IM, fractionner la dose et administrer en des sites différents. Contre-
indications Hypersensibilité à l'un des composants. Voie IM contre-indiquée en cas de
thrombocytopénie sévère ou d'autres troubles de l'hémostase. Mises en garde spéciales et
précautions particulières d’emploi* : Après l'accouchement, l'Ig anti-D est destinée à la mère.
Ne pas administrer au nouveau-né. Ne pas utiliser chez les sujets Rh(D)-positif. Maintenir les
patients en observation pendant 20 mn au moins après l’administration. En cas de réaction allergique
ou anaphylactique, interrompre immédiatement l'administration. Informer les patients des premiers
signes d'une réaction d'hypersensibilité. En cas de choc, instaurer un traitement symptomatique.
Les mesures habituelles de prévention du risque de transmission d’agents infectieux par les médicaments
préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs,
la recherche des marqueurs spécifiques d’infection sur chaque don et sur les mélanges de plasma
ainsi que la mise en œuvre dans le procédé de fabrication d’étapes efficaces pour l’inactivation /
élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain
sont administrés, le risque de transmission d’agents infectieux ne peut pas être totalement exclu.
Ceci s’applique également aux virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés (VIH, VHB et VHC).
Elles peuvent être d’efficacité limitée vis-à-vis des virus non enveloppés (VHA et parvovirus B19).
L’expérience clinique avec les Ig montre l’absence de transmission du VHA ou du parvovirus B19
et laisse également supposer que la présence d’anticorps contribue de façon importante à la
sécurité virale. Il est fortement recommandé lors de chaque administration de RHOPHYLAC à un
patient, d’enregistrer le nom et le numéro de lot du médicament, afin de maintenir un lien entre
le patient et le lot du produit. Interactions* : Reporter l'immunisation active avec des vaccins à
virus vivant atténué de 3 mois après la dernière administration de l'Ig anti-D car l'efficacité du vaccin
peut être altérée. Si l’Ig anti-D administrée dans les 2 à 4 semaines qui suivent cette vaccination, son
efficacité peut être altérée. Augmentation transitoire des anticorps transférés passivement dans le sang
du patient (p. ex. test de Coombs positif chez le nouveau-né). RHOPHYLAC peut renfermer des anticorps
dirigés contre d'autres antigènes Rh, p. ex. anti-Rh(C), qui peuvent être détectés après administration.
Grossesse et allaitement* : Médicament destiné à une utilisation pendant la grossesse. Aucun
événement indésirable imputable au médicament n'a été rapporté chez les enfants. Effets
indésirables* : Douleur et sensibilité locales au point d'injection. Hyperthermie, malaise, céphalées,
réactions cutanées et frissons occasionnels. Rares cas de nausées, vomissements, hypotension artérielle,
tachycardie et réactions de type allergique ou anaphylactique (dyspnée, choc), même en l'absence
d'hypersensibilité du patient lors d'une administration précédente. Surdosage* : Aucune donnée
disponible. Surveillance clinique et biologique en raison du risque de réaction hémolytique.
Incompatibilités : Ne pas mélanger avec d'autres médicaments. Conservation : 3 ans, conserver
la seringue (conditionnement primaire) dans l’emballage extérieur, au réfrigérateur (entre 2°C et 8°C)
et à l'abri de la lumière. Ne pas congeler. Tenir hors de la portée et de la vue des enfants. Précautions
particulières d’élimination et de manipulation* : Usage unique (une seringue-un patient).
Titulaire de l'Autorisation de Mise sur le Marché : LFB BIOMEDICAMENTS- 3, avenue des
Tropiques - BP 305 - LES ULIS - 91958 Courtabœuf Cedex - FRANCE. AMM n° : 363 970-2 : 2 ml
(200 microgrammes) - 363 971-9 : 2 ml (300 microgrammes). JUIN 2004/FEVRIER 2006. Liste I. Agréé
Collectivités. Remboursé Sécurité Sociale à 100 %. Prix public TTC : RHOPHYLAC 200 µg/2 ml : 61,57 €,
• RHOPHYLAC 300 µg/2 ml : 85,16 €.
*Pour une information complète, se reporter au RCP ou au dictionnaire des spécialités
pharmaceutiques.
JUILLET 2007 - 06G0486/3.0
RCP Rhophylac 180x120 24/09/07 13:59 Page 1
1
/
3
100%