Lire l'article complet

La Lettre du Gynécologue - n° 326 - novembre 2007
Congrès
Congrès
38
Quatrième congrès de la Société de chirurgie
gynécologique et pelvienne
IP N. Castaing*
* CHI Jean-Rostand, service de gynécologie obstétrique (J. Belaïsch-Allart) 141, Grande-Rue,
92317 Sèvres.
Le quatrième congrès de la SCGP organisé par le Pr P.
Descamps et le Dr L. Catala s’est tenu à Angers du 10
au 12 mai 2007 sous la présidence du Pr Jacques Lan-
sac. Quelques quatre cents participants ont pu ainsi débattre
autour de cent douze conférences, communications, ateliers
et posters sur les thèmes d’actualité en chirurgie gynécologi-
que : chirurgie de l’endométriose, du prolapsus, de la fertilité,
chirurgie oncologique pelvienne et mammaire.
RAPPORT DES PRINCIPALES COMMUNICATIONS
L’EPP en chirurgie gynécologique : c’est quoi ?
J. Lansac, E. Daraï, G.F. Blum, L. Boubli
L’évaluation des pratiques professionnelles (EPP) est obliga-
toire depuis août 2004 pour tous les médecins quel que soit
leur mode d’exercice. Cette obligation fait partie de la FMC
(formation médicale continue) qui comprend donc l’actua-
lisation des connaissances et l’EPP. L’acquisition des crédits
d’EPP repose sur la réalisation d’audit, de revue de pairs et
mise en place d’indicateurs de qualité des soins : participer à
un comité pluridisciplinaire, déclarer les événements porteurs
de risque, participer à un programme hospitalier de recherche
clinique, participer aux actions du CLIN, mettre en place des
protocoles fondés sur les recommandations de bonnes pra-
tiques. Ces actions doivent pouvoir être démontrées par des
cahiers de comptes-rendus. Pour prétendre à l’accréditation
spécifique en gynécologie obstétrique (décret 21 juillet 2006)
attribuée par l’HAS, l’acquisition de cent crédits d’EPP (sur les
deux cent cinquante crédits de FMC à acquérir sur cinq ans)
est obligatoire. L’accréditation peut être donnée pour quatre
ans individuellement ou à une équipe de la même spécialité
exerçant dans la même clinique ou hôpital. Les praticiens
accrédités pourront bénéficier d’une aide à la souscription de
l’assurance en responsabilité civile (9 000 euros). En cas de
manquements répétés à ses obligations, le praticien peut être
mis en demeure par l’HAS de les respecter, et à l’issue d’une
période de trois mois, lui retirer son accréditation et le noti-
fier au conseil de l’ordre et à la CME de son établissement. Le
CNGOF a fait une demande d’agrément pour l’EPP commune
avec le SYNGOF et la SCGP. Une commission d’évaluation
devrait assurer la formation de médecins experts qui assure-
ront l’évaluation des dossiers des gynécologues obstétriciens.
Un organisme (Gynérisq) auprès duquel les événements por-
teurs de risques doivent être déclarés, a été mis en place. Les
accidents graves (liste à définir) doivent être déclarés à l’InVS.
Gageons que l’EPP devienne plutôt une façon de travailler au
quotidien qu’une charge supplémentaire qui sera difficile à
réaliser et à appliquer…
Place du ganglion sentinelle en chirurgie
gynécologique pelvienne
P. Mathevet
La connaissance du statut ganglionnaire régional est un facteur
pronostique important pour les tumeurs pelviennes gynécolo-
giques. Depuis une dizaine d’années, le concept du ganglion
sentinelle (GS) s’est développé pour des cancers sélectionnés :
mélanomes malins et cancer du sein. Trois avantages majeurs
sont apportés par cette technique : réduction de la morbidité
du curage ganglionnaire, détection des voies de drainages
aberrantes, étude ciblée sur les GS par coupes semi-sériées
et immunohistochimie. De nombreuses études permettent de
réaliser une synthèse des applications attendues pour les can-
cers gynécologiques pelviens.
Cancer du col : cette localisation a bénéficié des études les
plus importantes pour les cancers au stade précoce IA2/B1 de
moins de 4 cm. La recherche du GS est maintenant bien codi-
fiée par double repérage au bleu et par traceur isotopique. La
recherche se fait par laparoscopie et doit être menée de façon
bilatérale. Actuellement, le prélèvement et l’analyse extempo-
ranée du GS sont systématiquement suivis d’une lymphadé-
nectomie iliaque bilatérale. L’analyse de la littérature permet
de conclure que cette technique est réalisable avec un taux de
faux négatifs proche de 0. Dans 15 % des cas, un trajet aberrant
est repéré. Les conséquences pratiques en cas de détection de
micrométastases restent à définir. Une étude multicentrique
française est actuellement en cours.
Cancer de l’endomètre : depuis les premières études publiées
en 1994, les données actuelles ne permettent pas de déter-
miner, de manière fiable, la place et l’intérêt du GS pour les
cancers de l’endomètre. Le taux de faux négatifs reste élevé,
probablement lié aux problèmes soulevés par le site d’injec-
tion. La tendance actuelle consiste en une injection péricer-
vicale associée à une injection sous-muqueuse au niveau du
fond utérin. Cette technique doit être actuellement proposée
dans le cadre d’un protocole de recherche clinique.
Cancer de la vulve : des études déjà anciennes montrent que
la technique par injection combinée est réalisable avec un
taux de détection du GS élevé (proche de 100 %) et un taux
de faux négatifs très réduit. Cependant, les effectifs des étu-
des publiées sont faibles et il faut attendre les résultats de

La Lettre du Gynécologue - n° 326 - novembre 2007
Congrès
Congrès
39
l’EORTC en cours. En cas de validation, cela devrait réduire de
façon importante la morbidité de la prise en charge chirurgi-
cale pour les cancers vulvaires de taille limitée et en l’absence
d’adénopathies inguinales suspectes.
Cancer du vagin et de l’ovaire : les données actuelles sont
très limitées et si l’on peut attendre un bénéfice de la tech-
nique pour les cancers du vagin, l’intérêt semble limité pour
l’ovaire.
Faut-il réellement opérer les endométrioses
profondes ?
Pour : M. Canis
La chirurgie de l’endométriose infiltrante est à risque de com-
plications (notamment fistules urinaires ou digestives), mais
celles-ci doivent être mises en balance avec les douleurs par-
fois invalidantes dans cette forme de la maladie. L’indication
opératoire doit donc tenir compte du contexte : les patientes
asymptomatiques ne devraient être opérées que dans deux
situations : endométriose périuretérale ou lésion vaginale pure
devant être opérée pour une autre raison (exemple : bilan d’in-
fertilité). Par ailleurs, il faut opérer les patientes atteintes d’une
endométriose infiltrante symptomatique, malgré une aménor-
rhée sous traitement médical. Dans ce cas, la chirurgie n’est
pas une urgence, mais reste le seul traitement curatif que l’on
puisse proposer. L’indication opératoire et la réalisation du
geste sont du ressort d’une équipe chirurgicale entraînée, par-
fois multidisciplinaire. Quant à l’abstention chirurgicale, elle
ne se conçoit que sous surveillance clinique régulière et après
un interrogatoire soigneux. Si la lésion augmente de volume,
il faut opérer, la chirurgie pouvant être plus aisée pour les
lésions de volume limité.
Contre : H. Fernandez
La prise en charge d’une endométriose profonde nécessite la
réalisation préalable d’un bilan complet de la maladie : interro-
gatoire soigneux précisant la séméiologie de la douleur éven-
tuelle, échographie pelvienne, échographie endorectale et/ou
IRM. De la qualité du diagnostic dépend la qualité de la prise
en charge. La reconnaissance de la pathologie est néanmoins
souvent retardée et son implication causale dans le symptôme
dominant reste parfois difficile à évaluer. Enfin, le contexte
demeure un point capital à définir si l’on considère les deux
symptômes les plus fréquents attribuables à l’endométriose
profonde, l’infertilité et la douleur. En effet, les patientes avec
un désir de grossesse et souffrant d’endométriose profonde
ne justifient pas de la chirurgie, mais d’une aide médico-
psychologique (AMP), l’endométriose n’intervenant pas sur
les chances de succès de ces techniques. Pour les patientes
qui ont des douleurs importantes, les recommandations du
CNGOF rejoignent celles du Royal College et de l’ACOG : un
traitement médical visant la suppression prolongée des règles
doit être prescrit en première intention avant de réaliser une
cœlioscopie diagnostique. La durée optimale de ce traitement
n’est pas définie, mais le développement des agonistes de la
LH-RH associé à l’add-back therapy permet de traiter durant
de longs mois en redonnant à ces patientes un confort de vie.
Pour celles qui souffrent malgré les traitements médicaux, on
s’oriente vers une prise en charge chirurgicale. L’information
préopératoire ne doit pas omettre de préciser dans ce cas que
l’efficacité d’un geste optimal, réalisé par une équipe multidis-
ciplinaire entraînée, sera efficace dans 60 à 100 % des douleurs
avec un risque de 4 à 15 % de complications digestives et de
20 % de séquelles fonctionnelles urinaires et/ou sexuelles.
Chirurgie du sein : l’oncoplastie pour les nuls
I. Garrido, D. Ganglo, D. Querleu
Au début des années 1970, l’équivalence en termes de survie
entre le traitement conservateur et la mastectomie pour la
prise en charge du cancer du sein a été démontrée. Depuis, la
chirurgie oncoplastique a développé des techniques permet-
tant d’en augmenter les indications et de diminuer les séquel-
les cosmétiques. Le principe consiste à utiliser les techniques
de chirurgie plastique mammaire dans le même temps que le
geste carcinologique. Une formation spécifique, à la frontière
entre chirurgie carcinologique et plastique, doit être entre-
prise dans les centres spécialisés en chirurgie mammaire.
Au-delà du geste technique, les bonnes indications doivent
être débattues en collaboration multidisciplinaire lors de la
mise en place du traitement. Cela pourrait concerner 15 %
des patientes, en particulier lorsque l’évaluation préopératoire
rend prévisible le recours à cette technique.
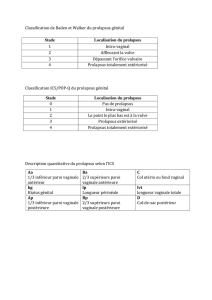
Pathogénie des prolapsus et concepts thérapeutiques
R. Villet
Les prolapsus génito-urinaires, quel que soit le compartiment
intéressé, urologique, gynécologique ou digestif, sont liés à
une dégradation des systèmes d’amarrage des viscères et/ou
du plancher pelvien. Ces dégradations sont secondaires à une
fragilité spontanée ou acquise des tissus de soutien, résultat de
traumatismes directs ou de sollicitations trop fortes ou inadap-
tées comme l’hyperpression abdominale chronique quelle qu’en
soit la cause. Le support anatomopathologique de ces dégrada-
tions est conjonctif, neurologique et musculaire intrinsèque ou
secondaire à une atteinte neurologique. Dans l’état actuel des
connaissances, nul ne sait réparer le conjonctif, les nerfs et les
muscles. Traiter un prolapsus c’est donc faire appel à d’autres
moyens pour replacer, suspendre et/ou maintenir les parois du
vagin et les viscères pelviens. Ces moyens utiliseront les tissus
naturels de la patiente ou feront appel à des tissus hétérolo-
gues ou synthétiques de renforcement. Leur réalisation se fait
par voie abdominale (laparotomie ou laparoscopie) ou par voie
vaginale. La voie abdominale a le mérite d’être parfaitement
standardisée. Dans tous les cas, la technique choisie évitera de
créer ou de favoriser de nouvelles dégradations anatomiques ou
de nouveaux troubles fonctionnels.
Chirurgie du prolapsus : que faut-il faire si l’on s’en
tient strictement à l’EBM ?
M. Cosson, F. Sabban, J.P. Lucot, P. Collinet
Malgré le nombre important de publications sur le sujet, les

La Lettre du Gynécologue - n° 326 - novembre 2007
Congrès
Congrès
40
études apportant un niveau de preuve satisfaisant pour l’EBM
sont rares. Dans la plupart des cas, il n’a pas été réalisé d’éva-
luation de la qualité de vie postopératoire concernant le reten-
tissement sur les fonctions urinaires, digestives et sexuelles à
partir de questionnaires validés. De plus, si l’on considère le
caractère très “opérateur-dépendant” du traitement chirurgi-
cal du prolapsus, seul un grand nombre d’études randomisées
sur le même sujet permettraient de s’affranchir de ce facteur.
Le plus souvent, les techniques “de référence” elles-mêmes
n’ont pas été validées selon les critères de l’EBM. Les consé-
quences actuelles pour la bonne pratique clinique ont été tirées
des études randomisées recensées dans la Cochrane Database.
La voie abdominale (sacropexie avec prothèse) semble supé-
rieure à la voie vaginale (sans prothèse). En effet, la réalisation
d’une promontofixation par voie abdominale (laparotomie ou
cœlioscopie) est significativement associée à un plus faible
taux de récidive de prolapsus et moins de dyspareunies que
la colpopexie par sacro-spinofixation réalisée par voie vagi-
nale. Cependant, la voie abdominale est associée à un temps
d’intervention plus long, une durée d’hospitalisation prolon-
gée et un coût plus élevé que la voie vaginale. L’utilisation de
la cœlioscopie permet de diminuer la durée d’hospitalisation
par rapport à la laparotomie avec, cependant, une durée plus
longue que la voie vaginale. L’utilisation de prothèses synthé-
tiques non résorbables, de type polypropylène dans le traite-
ment de la cystocèle par voie vaginale, semble réduire le risque
de récidive comparativement aux techniques classiques sans
prothèse, mais le retentissement sur les fonctions sexuelles,
urinaires et digestives est encore incertain. Le traitement par
voie vaginale du mur postérieur permet d’obtenir de meilleurs
résultats en termes de récidive que la voie transanale. Des
études randomisées sur le traitement du prolapsus par voie
vaginale avec prothèses sont en cours pour évaluer, en par-
ticulier, le taux d’érosion vaginale. Un rapport de l’HAS doit
être publié prochainement et pourrait ne pas être en faveur
de ces techniques dont les kits ne sont actuellement pas rem-
boursés, compte tenu du faible niveau de preuve des données
fournies et de l’existence d’alternatives thérapeutiques. n
RHOPHYLAC 200 microgrammes/2 ml, RHOPHYLAC 300 microgrammes/2 ml
Composition : Immunoglobuline humaine anti-D (Rh), solution injectable en seringue préremplie, 2 ml :
• Ig anti-D 1000 UI (200 microgrammes) soit 500 UI (100 microgrammes) par ml. Protéines plasmatiques
humaines
25 mg/ml* • Ig anti-D 1500 UI (300 microgrammes) soit 750 UI (150 microgrammes)
par ml. Protéines plasmatiques humaines
30 mg/ml*
* dont 10 mg/ml d'albumine humaine (stabilisant) et
95 % d'IgG. IgA
5 µg/ml.
Excipients : albumine humaine, glycine, chlorure de sodium, eau ppi.
Indications : Prévention de l’allo-immunisation fœtomaternelle Rh(D) chez les femmes
Rh(D)-négatif : grossesse / accouchement d’un enfant Rh(D)-positif, fausse couche / menace de fausse
couche / grossesse ectopique ou môle hydatiforme, hémorragie transplacentaire secondaire à une
hémorragie pré-partum, amniocentèse, biopsie de villosité choriale ou manœuvres obstétricales,
telles que version céphalique externe ou traumatisme abdominal. Traitement des sujets Rh(D)-
négatif après transfusions incompatibles de sang Rh(D)-positif ou d'autres produits contenant
des hématies Rh(D)-positif. •Posologie* : Respecter les directives professionnelles en vigueur.
Schémas recommandés : Prévention de l’allo-immunisation fœtomaternelle Rh(D) chez les
femmes Rh(D)-négatif • Prophylaxie avant l'accouchement : dose unique de 300 µg (1500 UI) IV
ou IM à 28-30 semaines de grossesse. • Prophylaxie après l'accouchement : 200 µg (1000 UI) IV
ou de 200 µg (1000 UI) à 300 µg (1500 UI) IM. Administrer RHOPHYLAC le plus tôt possible dans
les 72 heures qui suivent l'accouchement. Administrer également la dose postpartum si une
prophylaxie antepartum a été administrée. Si hémorragie fœtomaternelle importante (> 4 ml (0,7 % -
0,8 % des femmes)) soupçonnée (ex. : anémie fœtale, mort fœtale intra-utérine), estimer son
intensité par un test de Kleihauer-Betke : administrer des doses complémentaires d'Ig anti-D à raison
de 20 µg/100 UI par ml d'hématies fœtales.• Prophylaxie après une complication de la grossesse :
- Interventions et incidents 12 semaines de grossesse : 200 µg (1000 UI) IV ou IM. - Interventions
et incidents > 12 semaines de grossesse : au moins 200 µg (1000 UI) IV ou IM. - Prélèvement de villosités
choriales : 200 µg (1000 UI) IV ou IM. Administrer RHOPHYLAC dès que possible, sans dépasser
72 heures après l'événement à risque. Transfusions incompatibles : Dose recommandée : 20 µg
(100 UI) d’Ig anti-D pour 2 ml de sang Rh(D)-positif transfusés ou par ml de concentré érythrocytaire.
Injection IV recommandée. En cas d'injection IM : si les doses sont importantes, les administrer sur
plusieurs jours. Dose maximale de 3000 µg suffisante dans le cas d'importantes transfusions
incompatibles, indépendamment du fait que le volume de transfusion soit > à 300 ml de sang
Rh(D)-positif. Mode d'administration : RHOPHYLAC peut être administré par injection IV ou IM.
En cas de troubles hémorragiques contre-indiquant les injections IM, administrer par voie IV. Si dose
importante (> 5 ml) et voie IM, fractionner la dose et administrer en des sites différents. Contre-
indications Hypersensibilité à l'un des composants. Voie IM contre-indiquée en cas de
thrombocytopénie sévère ou d'autres troubles de l'hémostase. Mises en garde spéciales et
précautions particulières d’emploi* : Après l'accouchement, l'Ig anti-D est destinée à la mère.
Ne pas administrer au nouveau-né. Ne pas utiliser chez les sujets Rh(D)-positif. Maintenir les
patients en observation pendant 20 mn au moins après l’administration. En cas de réaction allergique
ou anaphylactique, interrompre immédiatement l'administration. Informer les patients des premiers
signes d'une réaction d'hypersensibilité. En cas de choc, instaurer un traitement symptomatique.
Les mesures habituelles de prévention du risque de transmission d’agents infectieux par les médicaments
préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs,
la recherche des marqueurs spécifiques d’infection sur chaque don et sur les mélanges de plasma
ainsi que la mise en œuvre dans le procédé de fabrication d’étapes efficaces pour l’inactivation /
élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain
sont administrés, le risque de transmission d’agents infectieux ne peut pas être totalement exclu.
Ceci s’applique également aux virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés (VIH, VHB et VHC).
Elles peuvent être d’efficacité limitée vis-à-vis des virus non enveloppés (VHA et parvovirus B19).
L’expérience clinique avec les Ig montre l’absence de transmission du VHA ou du parvovirus B19
et laisse également supposer que la présence d’anticorps contribue de façon importante à la
sécurité virale. Il est fortement recommandé lors de chaque administration de RHOPHYLAC à un
patient, d’enregistrer le nom et le numéro de lot du médicament, afin de maintenir un lien entre
le patient et le lot du produit. Interactions* : Reporter l'immunisation active avec des vaccins à
virus vivant atténué de 3 mois après la dernière administration de l'Ig anti-D car l'efficacité du vaccin
peut être altérée. Si l’Ig anti-D administrée dans les 2 à 4 semaines qui suivent cette vaccination, son
efficacité peut être altérée. Augmentation transitoire des anticorps transférés passivement dans le sang
du patient (p. ex. test de Coombs positif chez le nouveau-né). RHOPHYLAC peut renfermer des anticorps
dirigés contre d'autres antigènes Rh, p. ex. anti-Rh(C), qui peuvent être détectés après administration.
Grossesse et allaitement* : Médicament destiné à une utilisation pendant la grossesse. Aucun
événement indésirable imputable au médicament n'a été rapporté chez les enfants. Effets
indésirables* : Douleur et sensibilité locales au point d'injection. Hyperthermie, malaise, céphalées,
réactions cutanées et frissons occasionnels. Rares cas de nausées, vomissements, hypotension artérielle,
tachycardie et réactions de type allergique ou anaphylactique (dyspnée, choc), même en l'absence
d'hypersensibilité du patient lors d'une administration précédente. Surdosage* : Aucune donnée
disponible. Surveillance clinique et biologique en raison du risque de réaction hémolytique.
Incompatibilités : Ne pas mélanger avec d'autres médicaments. Conservation : 3 ans, conserver
la seringue (conditionnement primaire) dans l’emballage extérieur, au réfrigérateur (entre 2°C et 8°C)
et à l'abri de la lumière. Ne pas congeler. Tenir hors de la portée et de la vue des enfants. Précautions
particulières d’élimination et de manipulation* : Usage unique (une seringue-un patient).
Titulaire de l'Autorisation de Mise sur le Marché : LFB BIOMEDICAMENTS- 3, avenue des
Tropiques - BP 305 - LES ULIS - 91958 Courtabœuf Cedex - FRANCE. AMM n° : 363 970-2 : 2 ml
(200 microgrammes) - 363 971-9 : 2 ml (300 microgrammes). JUIN 2004/FEVRIER 2006. Liste I. Agréé
Collectivités. Remboursé Sécurité Sociale à 100 %. Prix public TTC : RHOPHYLAC 200 µg/2 ml : 61,57 €,
• RHOPHYLAC 300 µg/2 ml : 85,16 €.
*Pour une information complète, se reporter au RCP ou au dictionnaire des spécialités
pharmaceutiques.
JUILLET 2007 - 06G0486/3.0
RCP Rhophylac 180x120 24/09/07 13:59 Page 1
1
/
3
100%