Open access

Rev Med Liège 20xx; 6x : x : xx 1
I
ntroductIon
La maladie de Parkinson (MP) est classique-
ment connue pour affecter la motricité : lenteur et
pauvreté des gestes, tremblement, rigidité plastique
et troubles du maintien postural. Cependant, les
manifestations non-motrices, autrefois négligées et
méconnues, attirent un intérêt croissant de la com-
munauté médicale en raison de leur apparition par-
fois très précoce dans l’évolution (même avant les
premiers troubles détectables de la motricité), leur
prévalence élevée et les répercussions fonctionnel-
les souvent redoutables de certaines d’entre elles.
Une atteinte des fonctions cognitives dans la MP
est clairement établie depuis plus d’une vingtaine
d’années (1). Une démence apparaît chez 80% des
patients après 20 ans d’évolution (2). Jusqu’en
2007, il n’existait aucun critère diagnostique propre
à la démence parkinsonienne. Aussi, le DSM-IV
classait la démence parkinsonienne dans la catégo-
rie des «Démences dues à une autre pathologie».
En 2007, la «Movement Disorder Society» a défini
des critères cliniques précis permettant à la fois de
développer les études cliniques et thérapeutiques
et également de mieux comprendre l’histoire natu-
relle de la démence parkinsonienne (3).
D’un point de vue neuropathologique la MP
est caractérisée par une dégénérescence des
neurones du locus niger et d’autres noyaux du
tronc cérébral. Les études neuropathologiques
de cohortes de patients parkinsoniens suivis lon-
gitudinalement indiquent que la démence peut
être déterminée par trois grands substrats neu-
ropathologiques qui ne sont pas nécessairement
étanches (4) :
1) la progression des lésions neuropatholo-
giques vers le cortex cérébral (corps de Lewy
corticaux);
2) une atteinte pathologique sévère de noyaux
profonds du cerveau (notamment cholinergi-
ques) qui envoient des projections vers le cortex
cérébral produisant ainsi une «démence sous-
corticale»;
3) une maladie d’Alzheimer coexistant avec
la MP.
Une démence qui survient précocement sera
préférentiellement associée à un phénotype
neuropathologique de type cortical tandis que
la démence sous-corticale se rencontrera plus
volontiers chez les patients dont la maladie a
évolué longtemps avant le début de la démence.
Dans cet article, après une brève revue de l’as-
pect épidémiologique, nous détaillerons les fac-
teurs de risque en cause dans le développement
de la démence ainsi que ses caractéristiques cli-
niques et les différents outils à notre disposition
pour établir son diagnostic et la traiter.
A
spects
épIdémIologIques
Alors que la prévalence de la démence par-
kinsonienne est estimée de 0,3 à 0,5% dans la
S. Ba k a y (1), S. Be c h e t (2), a. Ba r j o n a (2), V. De l V a u x (3), e. Sa l m o n (4), G. Ga r r a u x (5)
LA DÉMENCE CHEZ LE PATIENT PARKINSONIEN :
facteurs de risque, diagnostic et traitement
(1) Etudiante de 4ème master de Médecine, Université
de Liège.
(2) Neuropsychologue, (3) Professeur de Clinique, (4)
Chargé de cours, (5) Maître de Recherche FNRS, Groupe
MOVERE, Service de Neurologie, CHU de Liège.
RESUME : A côté du tremblement, de la bradykinésie, de la
rigidité musculaire et des troubles de la marche, la maladie de
Parkinson se présente également par des troubles non-moteurs.
Parmi ceux-ci, des difficultés cognitives peuvent apparaître
précocement, voire précéder le diagnostic et ont un retentis-
sement important sur la qualité de vie. La démence n’est pas
inéluctable mais affecterait plus de 80% des patients après 20
ans d’évolution. Les facteurs de risque d’une évolution vers la
démence et le diagnostic de celle-ci sont aisément déterminés
lors d’une consultation ou au chevet du malade à l’aide d’outils
cliniques simples disponibles depuis peu. Des progrès, en géné-
tique et en imagerie, devraient nous permettre d’améliorer
encore le diagnostic et les stratégies thérapeutiques.
m
o t s
-
c l é s
: Maladie de Parkinson - Démence - Diagnostic -
Traitement
d
e m e n t I A
I n
p
A r k I n s o n
’
s
d I s e A s e
:
r I s k
f A c t o r s
,
d I A g n o s I s
A n d
t r e A t e m e n t
SUMMARY : Aside from limb tremor, bradykinesia, rigidity
and gait disturbances, Parkinson’s disease (PD) is also cha-
racterized by non-motor symptoms. A cognitive decline can
occur early in the disease course and undoubtedly impact of
the patient’s quality of life. Dementia affects 80% of patients
20 years after disease onset but a small subgroup of patients
remain free of dementia even after decades with PD. Risk fac-
tors and diagnosis of dementia can be easily assessed using
bed-side clinical instruments. Advances in genetics and imagery
will allow improving the diagnosis and therapeutic strategy of
dementia in Parkinson’s disease.
k
eywords
: Parkinson’s disease - Dementia - Diagnosis -
Treatment

S. Ba k a y e t coll.
Rev Med Liège 20xx; 6x : x : xx
2
population générale de plus de 65 ans, elle est de
3 à 4% dans la population de patients déments
et 22 à 48% parmi les patients parkinsoniens
(5). Chez les patients parkinsoniens, on estime
le risque de conversion vers une démence à 10%
par an. Dans une étude longitudinale, 83% des
patients parkinsoniens survivants après 20 ans
d’évolution avaient développé une démence (2).
L’intervalle moyen entre le début de la MP et le
développement d’une démence est approximati-
vement de 10 ans (6). La MP est donc associée
à un risque accru de démence.
Bien qu’une évolution vers la démence soit
inéluctable chez la majorité des patients parkin-
soniens, les études longitudinales ont également
identifié un sous-groupe de patients qui ne déve-
loppent pas de démence malgré une évolution de
plusieurs décennies. Plusieurs facteurs de risque
ont été identifiés pour expliquer ces variations
interindividuelles.
f
Acteurs
d e
rIsque
d
’
une
démence
chez
l e
pAtIent
AtteInt
p A r
l A
mAlAdIe
d e
p
ArkInson
Nous en avons répertorié sept. La plupart peu-
vent être évalués en quelques minutes en consul-
tation ou au chevet du malade.
A
g e
e t
d u r é e
d
’
é v o l u t i o n
L’âge (supérieur à 72 ans), l’âge du patient au
moment du diagnostic de MP et la durée d’évo-
lution de la maladie sont tous trois étroitement
corrélés à un risque accru de démence (7). Bien
que l’importance relative de chacun de ces fac-
teurs soit difficilement appréciable, les résultats
d’Aarsland et coll. (2007) montrent que l’âge du
patient est celui qui prédit le mieux l’apparition
d’une démence endéans les 5 ans (8).
P
h é n o t y P e
m o t e u r
Plusieurs phénotypes «moteurs» ont été iden-
tifiés dans la MP. Alors que le risque de démence
est considéré comme faible dans les formes tré-
mulantes, il est nettement plus élevé chez les
patients faiblement répondeurs à la L-dopa qui
présentent des troubles axiaux prépondérants
(instabilité posturale par exemple) et une démar-
che festinante (9, 10).
En corollaire, le développement de la
démence est associé à un risque accru de chutes
et un déclin plus rapide des fonctions motrices.
Chez les patients parkinsoniens déments et non
déments, on observe respectivement une majo-
ration annuelle de 9,7 et 5,1 points à l’échelle
l’UPDRS III (11), communément utilisée pour
quantifier la progression de l’atteinte des fonc-
tions motrices.
P
h é n o t y P e
c o g n i t i f
g l o b A l
Williams-Gray et coll (2009) distinguent deux
types d’atteinte cognitive dans la MP, - à polarité
antérieure et postérieure - qui diffèrent par leur
présentation clinique, leur physiopathologie et
leur pronostic (7).
L’atteinte à polarité antérieure est typique-
ment de type dysexécutif. Elle est évaluée, par
exemple, par le test de la tour de Londres (Tower
of London) qui met en jeu la mémoire de travail
et les capacités de planification. Cette atteinte
apparaît tôt dans la maladie et est modulée par le
traitement dopaminergique. Cependant, ce pro-
fil cognitif ne semble pas représenter un facteur
de risque de démence parkinsonienne.
Par contre, il semblerait que l’atteinte cogni-
tive à polarité postérieure annonce, quant à elle,
le développement d’une démence. Ce profil
cognitif peut être identifié par un bilan neurop-
sychologique approfondi utilisant notamment
les tests de mémoire de reconnaissance visuelle
et spatiale.
i
n c A P A c i t é
à
r e P r o d u i r e
u n e
f i g u r e
P e n t A g o n A l e
Le dessin des deux pentagones entrecroi-
sés, proposé dans le Mini-Mental State Exam
(MMSE), doit être réalisé en respectant le nom-
bre d’angles et le croisement des 2 figures. Une
réalisation imparfaite de celui-ci est corrélée à un
risque de démence multiplié par 5.
r
A l e n t i s s e m e n t
d e s
f l u e n c e s
v e r b A l e s
s é m A n t i q u e s
Des déficits en fluence verbale ont été décrits
dans la MP en relation avec des troubles exé-
cutifs et de récupération en mémoire sémanti-
que. La diminution des performances dans les
fluences verbales en induction sémantique (par
exemple: moins de 20 noms d’animaux en 90
secondes) plutôt que phonémique est associée
à un risque relatif de démence multiplié par 9
(10).
t
r o u b l e s
n e u r o P s y c h i A t r i q u e s
-
h A l l u c i n A t i o n s
v i s u e l l e s
Les hallucinations dans la démence parkin-
sonienne sont fréquentes mais non spécifiques.
Elles peuvent être visuelles, auditives ou même
olfactives. Cependant, tout comme pour la mala-
die à corps de Lewy, on associe les hallucina-
tions visuelles à une augmentation du risque de
démence (12).

la démence chez l e patient parkinSonien
Rev Med Liège 20xx; 6x : x : xx 3
g
é n o t y P e
Selon plusieurs études, l’haplotype H1 du
gène codant pour la protéine Tau associée aux
microtubules (MAPT) confère un risque accru de
développer un déclin cognitif rapide dans la MP
(13-15). Tau est une protéine qui est principale-
ment exprimée dans les neurones où elle favorise
l’assemblage et la stabilité des microtubules (des
protéines du cytosquelette). Des variations allè-
liques au niveau de ce gène conduisent in fine à
une perte de fonction dont une des conséquences
est l’accumulation excessive de protéines intra-
cellulaires et la mort neuronale.
Selon une étude récente, un génotype «H1/
H1» chez un patient parkinsonien âgé de plus de
72 ans qui échoue à l’épreuve des pentagones et
qui présente une altération des fluences verba-
les en induction phonémique (moins de 20 mots
en 90 secondes) ont une valeur prédictive posi-
tive de 75% et une valeur prédictive négative de
87,5% de conversion vers une démence endéans
les 5 ans après le diagnostic de la MP (7).
I
mAgerIe
cérébrAle
En l’absence d’étude longitudinale, aucune
technique de neuroimagerie n’a permis jusqu’à
présent d’identifier une anomalie cérébrale fonc-
tionnelle ou anatomique prédictive de manière
précoce de l’évolution vers une démence chez
le patient parkinsonien.
Nous retiendrons qu’une diminution du débit
sanguin cérébral et de la consommation de
glucose semble plus prononcée au niveau du
cortex pariétal médial, des régions temporo-
parieto-occipitales latérales et temporales infé-
rieures chez les patients parkinsoniens à risque
de développer une démence (16) (Fig. 1). Ce
pattern métabolique s’apparente à celui habi-
tuellement observé dans la démence de type
Alzheimer. Cependant, ces anomalies seraient
présentes chez 30% des patients parkinsoniens
non-déments (17, 18).
d
émArche
dIAgnostIque
d
i A g n o s t i c
P
o s i t i f
Dubois et coll. (2007) (11) ont proposé un outil
clinique simple qui peut être utilisé en consulta-
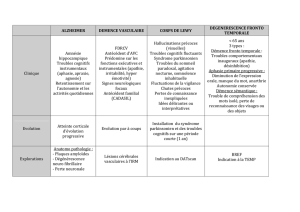
tion ou au chevet du patient (Tableau I).
1. Diagnostic de maladie Parkinson selon les
critères de «Queen Square Brain Bank Crite-
ria»(20).
2. Le diagnostic de maladie de Parkinson pré-
cède celui de la démence.
oui non
1. Maladie de Parkinson
2. La maladie de Parkinson débute
avant la démence
3. Score au MMSE < 26
4. La démence a un impact sur la qualité
de vie (ex : anamnèse médicamenteuse)
5. Atteinte cognitive; les performances
du patient sont déficitaires dans min
2 des 4 domaines cognitifs :
- attention : épreuve de
soustraction de «7»
au MMSE ou énumération
des mois de l’année à l’envers
- fonctions exécutives :
fluences verbales phonémiques
ou test de l’horloge
- capacités visuo-spatiales :
épreuve des pentagones du
MMSE
- mémorisation : rappel libre
différé à l’épreuve de
mémorisation des 3 mots du `
MMSE.
6. Pas de dépression majeure
7. Pas de troubles délirants
8. Pas d’autres anomalies
obscurcissant le diagnostic (infection, ...)
Diagnostic de démence parkinsonienne si une réponse
«oui» est apportée à chacun des 8 items
t
a B l e a u
i. F
e u i l l e
d e
c o t a t i o n
p o u r
é t a B l i r
u n
d i a g n o S t i c
d e
d é m e n c e
p a r k i n S o n i e n n e
p r o B a B l e
(11).
Figure 1. Images du métabolisme glucidique cérébral au repos par tomo-
graphie à émission de positons (PET scan) au 18FDG dans 4 situations
cliniques.
Coupes axiales transverses à hauteur des noyaux gris centraux;
de gauche à droite :
- Métabolisme glucidique cérébral chez un individu âgé normal.
- Diminution modérée de la captation du traceur au niveau des aires corticales
associatives postérieures chez un patient parkinsonien. Ce patient ne présen-
tait pas de signes cliniques de démence ni au moment du PET scan, ni 10 ans
plus tard (score normal à l’échelle de Mattis) (19).
- Diminution légèrement plus marquée de la captation du traceur au niveau
des aires corticales associatives postérieures chez un patient parkinsonien à
un stade pré-démentiel au moment de l’examen (score normal à l’échelle
de Mattis). Ce patient a développé ultérieurement une démence confirmée
notamment par une détérioration significative du score à l’échelle de Mattis
à 116/144 lors du bilan neuropsychologique approfondi réalisé 10 ans après
le PET scan.
- Altération marquée de la captation du 18FDG au niveau des aires associati-
ves postérieures et frontales chez un patient parkinsonien dément au moment
de l’examen.

S. Ba k a y e t coll.
Rev Med Liège 20xx; 6x : x : xx
4
3. La maladie de parkinson est associée à un
déficit global des capacités cognitives.
L’échelle de Mattis (19) est un instrument
pertinent pour évaluer les capacités cognitives
globales dans la MP (21) mais le MMSE (22)
est proposé ici pour sa rapidité et sa simplicité
d’utilisation. Le MMSE sous-estime l’atteinte
cognitive dans la MP et souffre d’un manque de
spécificité (50%). Une des explications possibles
est que seul un item (la copie de deux pentago-
nes entrecroisés) reflète une éventuelle atteinte
des fonctions visuo-spatiales (prévalentes chez
les sujets parkinsoniens). Le cut-off est placé à
26/30 et, compte tenu des variations dues à l’âge
et au niveau d’études, la validité de ce test se
limite à des sujets de moins de 80 ans et dont le
nombre d’années d’études est supérieur à 10.
4. Le déficit cognitif altère la qualité de vie
La difficulté ici réside à déterminer l’impact
des troubles cognitifs sur la qualité de vie par
rapport aux effets d’autres manifestations cli-
niques tels les troubles moteurs, la dépression
ou une dysautonomie. L’examinateur doit donc
évaluer la capacité du sujet parkinsonien à gérer
ses finances, utiliser le matériel à sa disposition,
gérer ses médicaments et conserver des relations
sociales stables. L’anamnèse médicamenteuse
du traitement antiparkinsonien (Tableau II) a été
proposée comme un instrument pertinent mais
doit encore être validé.
5. Déficits cognitifs dans plus d’un domaine
a. Attention
Deux tests sont proposés :
- la série de soustraction par 7 à partir de 100
présente dans le MMSE (échec si le nombre de
mauvaises réponses > 2);
- citer les mois à l’envers depuis « décembre
» (échec si nombre d’erreurs >2 ou temps d’exé-
cution > à 90 sec).
b. Fonctions exécutives
Deux tests sont proposés :
- Fluences verbales : il s’agit d’un test qui
évalue la capacité du sujet à mettre en place une
stratégie afin de retrouver une information. Ici,
on demande au sujet de citer un maximum de
mots appartenant à une catégorie phonologique
(commençant par une même lettre) en un mini-
mum de temps (1 min). Echec si le nombre de
mots < 9.
- Test de l’horloge : il est demandé de des-
siner une horloge indiquant 2h10. On évalue la
capacité du patient à inscrire les bons chiffres
au bon endroit ainsi que d’orienter les aiguilles
convenablement. Il s’agit également d’un test de
planification.
c. Les capacités visuo-constructives
- Le double pentagone du MMSE. Le nom-
bre d’angles doit être respecté et les 2 pentago-
nes doivent s’entrecroiser.
d. Troubles mnésiques
- Rappel différé du MMSE. On utilise les 3
mots du MMSE (Citron-Clé-Ballon) en rappel
libre. Un seul mot erroné ou manquant suffit à
suggérer un trouble de la mémoire.
D’autres critères sont souvent associés mais
non-spécifiques du diagnostic de démence asso-
ciée à la MP : apathie, dépression, anxiété, hal-
lucinations, délire,…
e
x c l u s i o n
d
’
A u t r e s
c A u s e s
- Examens complémentaires à programmer
éventuellement en fonction de l’examen clini-
que et de l’hétéroanamnèse : biologie (vitamine
B12, TSH, ...), scanner cérébral ou IRM céré-
brale (lésions vasculaires, hydrocéphalie normo-
tensive de l’adulte, atrophie cérébrale,…)
- Diagnostic différentiel entre la démence
associée à la MP et la démence à corps de Lewy
en se référant à la chronologie de l’apparition
des troubles cognitifs par rapport aux symptô-
mes moteurs. Par définition, ceux-ci précèdent
les troubles cognitifs de plus d’un an dans la
démence parkinsonienne au contraire de la
démence à corps de Lewy. De plus, la démence
à corps de Léwy se caractérise par la présence
de fluctuations cognitives avec des variations de
la vigilance et de l’attention, des hallucinations
visuelles récurrentes typiquement élaborées et
Pas d’impact Le patient est capable de décrire clairement et
spontanément le traitement médicamenteux anti
parkinsonien en précisant le nom, les doses (ou
la couleur des pilules) et l’horaire des prises des
médicaments
Impact possible L’anamnèse médicamenteuse est orientée par
l’examinateur (quand ? à quelle dose ?...) mais
le patient ne commet pas d’erreur; si l’aidant ou
le conjoint certifie que le patient est habituelle
ment capable de gérer son traitement médica
menteux sans supervision, il faut considérer
qu’il n’y a pas d’impact. Dans le cas contraire,
il faut considérer que les troubles cognitifs ont
un impact sur la qualité de vie.
Impact certain Le patient est incapable de décrire la composition,
les doses et l’horaire de son traitement médica
menteux même avec l’aide de l’examinateur.
t
a B l e a u
ii. «p
i l l
q u e S t i o n n a i r e
»
o u
a n a m n è S e
m é d i c a m e n t e u S e
d u
t r a i t e m e n t
a n t i
-
p a r k i n S o n i e n
S e r v a n t
à
é va l u e r
l
’
i m p a c t
d e S
t r o u B l e S
c o g n i t i F S
S u r
l a
q u a l i t é
d e
v i e

la démence chez l e patient parkinSonien
Rev Med Liège 20xx; 6x : x : xx 5
détaillées, des chutes fréquentes et des syncopes,
une perte de conscience transitoire inexpliquée,
des signes extra pyramidaux et une hypersensi-
bilité aux neuroleptiques (dans 50% des cas).
D’autres symptômes peuvent être rencontrés, de
type dysautonomique, comme une hypotension
orthostatique ou une incontinence urinaire.
- Exclure les troubles psychotiques iatrogè-
nes : delirium et effets iatrogènes des médica-
ments aux propriétés anti-cholinergiques (ex :
Anafranil
®
et autres tricycliques, Oxybutinine
®
et autres anti-spastiques vésicaux,...) du traite-
ment par agonistes dopaminergiques (Réquip
®
,
Mirapexin
®
, Permax
®
, Parldodel
®
), des benzo-
diazépines et autres psychotropes.
- Exclure toute autre cause de confusion du
sujet âgé : infection, déshydratation, fécalome,
globe vésical, désordre endocrinien,.... En géné-
ral, le diagnostic de démence n’est pas posé en
cas de dépression. Cependant, ce symptôme est
inhérent à la démence parkinsonienne. Il est
donc recommandé de tenir compte d’une éven-
tuelle altération des tests neuropsychologiques
et, au besoin, débuter une thérapie antidépres-
sive avant de diagnostiquer la démence.
t
rAItements
Le traitement de la démence parkinsonienne
se décline en 3 axes principaux :
1) Minimiser voir supprimer les causes iatro-
gènes et les facteurs intercurrents (vide supra);
2) Traitement pharmacologique;
3) Traitement non pharmacologique.
t
r A i t e m e n t
P h A r m A c o l o g i q u e
Deux classes médicamenteuses sont souvent
utilisées soit isolément ou en association : les
anticholinestérasiques (comme ceux utilisés
dans la maladie de type Alzheimer) et les neuro-
leptiques atypiques.
Anticholinestérasiques : la rivastigmine (Exelon
®
)
Une large étude randomisée en double aveu-
gle contre placébo a démontré l’efficacité de
cette substance dans la démence associée à la
MP (23). Cependant, on doit tenir compte des
effets indésirables, principalement digestifs
(nausées, vomissements), cardiologiques (risque
de syncope par bradyarythmie favorisée par l’ef-
fet vagotonique), et neurologiques (accentuation
des tremblements).
Neuroleptiques atypiques : Clozapine (Léponex
®
)
ou Quiétapine (Séroquel
®
)
La psychose due ou non au traitement dopa-
mimétique est l’un des problèmes soulevés chez
les patients Parkinsoniens traités. La clozapine
a montré un effet favorable dans l’évolution de
ces symptômes (24). La quiétapine, quant à elle,
est un nouveau traitement antipsychotique atypi-
que dont les effets indésirables extrapyramidaux
sont minimes, mais, dont les bénéfices demeu-
rent incertains chez les patients parkinsoniens
déments (25).
t
r A i t e m e n t
n o n
P h A r m A c o l o g i q u e
Les options non-médicamenteuses apparais-
sent primordiales. Elles comportent des expli-
cations (au patient et à ses proches) concernant
les différentes facettes du syndrome démentiel,
une bonne compréhension de la personnalité et
des modes de fonctionnement du patient, des
adaptations de l’environnement, et des adapta-
tions des activités quotidiennes (26). Lorsque le
patient est institutionnalisé, ces explications doi-
vent être transmises au personnel soignant afin
d’améliorer la qualité des soins par exemple en
réduisant la sévérité des épisodes d’agitation
(27).
Les patients parkinsoniens déments présen-
tent un risque accru de chutes par rapport aux
patients non-déments et les troubles attention-
nels sont un facteur prédictif des chutes. On
conseillera dès lors d’éviter toutes les situations
divisant l’attention durant la marche (ex : double
tâche). Dans certains cas on peut proposer des
exercices de correction de troubles de la marche
et de la posture sous la supervision directe d’un
kinésithérapeute familier avec ce type de patho-
logie. Au-delà de cette indication, des études
non-randomisées conduites chez un petit nom-
bre de patients suggèrent que la pratique régu-
lière d’exercices physiques pourrait diminuer le
risque d’aggravation des troubles cognitifs (prin-
cipalement les fonctions exécutives) des patients
parkinsoniens (28).
La constatation qu’un patient parkinsonien
dément éprouve des difficultés à retrouver spon-
tanément une information doit amener les pro-
ches à suggérer des indices de récupération en
mémoire ou à proposer des choix multiples (pour
utiliser un mode de reconnaissance en mémoire
plutôt qu’un rappel stratégique coûteux en res-
sources attentionnelles). Il est important d’adap-
ter le débit (verbal) des informations en fonction
du degré de ralentissement du patient.
Une horloge digitale est parfois plus facile
à lire pour rythmer par exemple la prise des
 6
6
 7
7
1
/
7
100%