Lire l'article complet

La Lettre du Cardiologue - n° 307 - février 1999
6
INFORMATIONS
a cardiologie interventionnelle continue de progresser
très rapidement. Les complications aiguës de l’angio-
plastie deviennent exceptionnelles, malgré l’extension
des indications à des lésions coronaires de plus en plus complexes.
Cette 5eréunion nationale du Groupe de réflexion sur la cardio-
logie interventionnelle s’est déroulée à Marne-la-Vallée les 6 et
7 décembre 1998. Elle a donné lieu à de nombreux échanges
d’idées, en particulier dans le cadre des ateliers de films sur les
stents perdus, l’angioplastie à la phase aiguë de l’infarctus ou le
stenting sans prédilatation, ou dans le cadre de controverses sur
le stenting des lésions longues (J. Fajadet, X. Favereau), sur la
prise en charge du choc cardiogénique (C. Spaulding, I. Laurent)
ou sur l’usage préventif de l’abciximab (A. Vahanian, B. Valeix).
Nous résumons ici les principaux thèmes abordés.
ANGIOPLASTIE À LA PHASE AIGUË
DE L’INFARCTUS
Les bénéfices du stent à la phase aiguë
de l’infarctus ont été confirmés par
l’étude STENTIM II (J.P. Monassier).
Dans cette indication, le stent Wiktor
diminue de 30 % le taux de nouvelle
revascularisation à 6 mois par rapport
au ballon.
L’amélioration des taux de survie
nécessite une reperfusion tissulaire
avec flux TIMI 3 dans les premières
heures de l’infarctus. La persistance
d’un flux ralenti (TIMI 2 ou slow-flow) en
aval du stent doit donc être considérée comme un échec de pro-
cédure. Cette absence de reperfusion tissulaire malgré une désobs-
truction coronaire réussie semble plus fréquente en cas d’angio-
plastie de sauvetage après échec de fibrinolyse. Elle pourrait être
favorisée par des embolies distales liées à la fragmentation du
caillot par le matériel d’angioplastie. Le Corvasal®intracoronaire
et le lavage du lit distal coronaire par du sérum physiologique
sont souvent inefficaces. Les traitements proposés associent le
vérapamil (200 µg intracoronaire renouvelable deux à trois fois
en cas de bonne tolérance hémodynamique et en l’absence de
trouble conductif) et l’abciximab. Une étude randomisée com-
parant stryadine et vérapamil est en cours. Un ballon intra-aor-
tique sera mis en place en cas de bas débit cardiaque. T. Lefèvre
propose de prévenir cet échec de reperfusion tissulaire en prati-
quant un stenting sans prédilatation, afin d’éviter la fragmenta-
tion du caillot par le ballon.
STENT ET LÉSIONS DE BIFURCATION
Le stent permet de traiter les lésions de bifurcation avec un taux
élevé de succès primaire (Y. Louvard, M.C. Morice). L. Maillard
a présenté les résultats immédiats et à long terme d’une série mul-
ticentrique de 95 patients dilatés et stentés sur des lésions de bifur-
cation. Le taux de succès de la procédure était de 98 %. Le taux
de nouvelle revascularisation à 6 mois était de 20 %, dont 17,5 %
par angioplastie et 2,5 % par pontage. Les 9 patients avec sténose
du tronc commun et contre-indication chirurgicale avaient le plus
mauvais pronostic (un infarctus et un décès). Chez les autres
patients, l’angioplastie avec stent des
bifurcations présente dans cette série un
taux élevé de succès primaire et de bons
résultats à long terme.
NOUVELLES TECHNOLOGIES
Le guide pression intracoronaire per-
met d’évaluer la réserve fonctionnelle
myocardique à partir de la mesure à
l’état basal et après adénosine du gra-
dient de pression secondaire à la sténose
coronaire. Ce guide permet ainsi de
quantifier le retentissement fonctionnel
des sténoses considérées comme inter-
médiaires en angiographie, et de discu-
ter en cours de procédure l’indication d’une éventuelle angio-
plastie (S. Cattan).
Plusieurs communications ont porté sur de nouveaux stents. Le
stent Wiktor hépariné à basse pression a été présenté par J. Marco.
Le stent couvert permet d’éviter une tamponnade secondaire à
une perforation coronaire par le guide d’angioplastie ou d’exclure
un anévrisme coronaire en obstruant son orifice d’entrée (D. Blan-
chard).
R. Bonan a présenté une revue complète de la littérature sur
l’irradiation coronaire dans la prévention de la resténose.L’ir-
radiation endocoronaire inhibe l’hyperplasie intimale et prévient
le remodelage constrictif. Les études randomisées SCRIPPS et
WRIST (iridium 192 vs placebo) objectivent sous irradiation une
diminution d’un facteur 4 du risque de nouvelle revascularisation
pour resténose. D’autres études sont en cours afin de confirmer
ces résultats préliminaires : étude BRIE (Beta Radiation In
Europe), étude START (Strontium 90 vs placebo), étude BERT
Cinquième réunion nationale du Groupe de réflexion sur
la cardiologie interventionnelle
●C. Le Feuvre*
*Service Pr A. Vacheron, Hôpital Necker, Paris.
L

La Lettre du Cardiologue - n° 307 - février 1999
7
INFORMATIONS
(suivi angiographique et par échographie endocoronaire), étude
GUIDANT, étude INHIBIT (traitement de la resténose intrastent
chez 320 patients), étude IRIS (qui utilise un stent radioactif,
l’Isostent : 32P - stent Palmaz-Schatz).
Le suivi à long terme conditionnera l’avenir de l’irradiation intra-
coronaire (risque potentiel de resténose tardive, de fibrose, d’ané-
vrisme coronaire). Aux États-Unis, la brachythérapie intracoro-
naire est réalisée dans une centaine de centres. Si les espoirs de
la brachythérapie se confirmaient, ce traitement pourrait être soit
appliqué en cas de résultat incomplet au ballon, en utilisant un
stent radioactif, soit réservé secondairement à la resténose intra-
stent.
TRAITEMENT DE LA RESTÉNOSE INTRASTENT
(H. Eltchaninoff)
Le stent est un progrès majeur en angioplastie, diminuant le taux
d’occlusion aiguë et de resténose à moyen terme. Il est, selon les
centres, utilisé dans 50 à 90 % des procédures. Le taux faible de
resténose des études randomisées (7 % dans BENESTENT 2) ne
reflète cependant pas la pratique courante. Le taux de resténose
intrastent est entre 20 et 30 % dans les registres (35 % dans le
centre de Washington). On peut estimer à 25 % le risque de nou-
velle dilatation après angioplastie avec stent. Cette resténose
intrastent est liée exclusivement à l’hyperplasie intimale. On dis-
tingue les resténose focales (< 10 mm), les formes diffuses
(> 10 mm), et les formes prolifératives (plusieurs centimètres,
dépassant le stent). Plusieurs techniques ont été proposées dans
le traitement de cette resténose, comme le ballon, les techniques
ablatives, et plus récemment le stent dans le stent, le ballon cou-
pant, les radiations ionisantes.
Traitement de la resténose intrastent par ballon
Le ballon agit par surexpansion du stent (56 %) et par extrusion
de la prolifération intimale à l’extérieur du stent (44 %). C’est la
première technique utilisée en raison de sa simplicité et de son
taux élevé de succès primaire (98 à 100 %). Le risque de nou-
velle resténose est cependant entre 50 et 60 % en cas de resté-
nose diffuse (tableau I). Il est plus faible en cas d’angioplastie
au ballon pour resténose focale : 11 % de revascularisation secon-
daire dans l’étude de Reimers (JACC 97).
Traitement de la resténose intrastent par athérectomie
La méthode la plus étudiée est l’athérectomie rotative complé-
tée par ballon. Elle agit par ablation (54 %), surexpansion du
stent (15 %) et extrusion de l’hyperplasie intimale à travers les
mailles du stent (31 %). Il est nécessaire d’utiliser un rapport
fraise/artère > 0,7 et de compléter systématiquement le rotabla-
tor par une angioplastie au ballon. Les taux de nouvelle revascu-
larisation pour deuxième resténose varient entre 19 % et 35 %.
La comparaison avec le ballon seul retrouve une tendance en
faveur du rotablator complété par ballon (tableau II).
Le laser complété par ballon agit par ablation (29 %), surexpan-
sion du stent (40 %) et extrusion de l’hyperplasie intimale à tra-
vers les mailles du stent (31 %). Le taux de revascularisation pour
nouvelle resténose varie de 21 % à 45 % dans quatre études por-
tant sur 25 à 151 patients.
L’athérectomie directionnelle a été utilisée par Cattelaens chez
28 patients (TCT 1998). Le taux de nouvelle resténose était de
50 %.
Autres traitements de la resténose intrastent
L’utilisation d’un second stent déployé dans le premier a été pro-
posée par plusieurs équipes avec un taux élevé de succès primaire
et des taux de nouvelle revascularisation allant de 17 % à 44 %
dans deux équipes françaises (tableau III), et de 8 % à 44 % dans
la littérature.
Le ballon coupant a été utilisé par Nakamura dans 194 lésions
de resténose intrastent, avec 31 % de resténoses angiographiques
et 23 % de nouvelles revascularisations.
L’abstention d’un nouveau geste d’angioplastie est licite en cas
de resténose intrastent asymptomatique. L’hyperplasie intimale
intrastent diminue à long terme dans 40 % des cas.
La chirurgie est proposée dans les resténoses itératives sympto-
matiques, avec ischémie étendue.
Les traitements locaux (thérapie génique) sont en cours d’expé-
rimentation animale. D’autres méthodes comme la radiothérapie
Resténose Nouvelle
angiographique revascularisation
pour resténose
Bauters (Circulation 1998)
série totale (n = 87) 22 % 17 %
resténose diffuse (n = 24) 53 %
Eltchaninoff (JACC 1998)
série totale (n = 57) 53 % 40 %
resténose diffuse (n = 40) 63 % 40 %
Tableau I. Taux de nouvelle resténose après angioplastie au ballon
pour resténose intrastent.
Resténose Nouvelle
angiographique revascularisation
pour resténose
Von Dahl (n = 100)
rotablator + ballon 49 % 35 %
Registre BARASTER (n = 155)
ballon 46 %
rotablator + ballon 32 %
Étude randomisée ROSTER
ballon 36 %
rotablator + ballon 19 %
Tableau II. Taux de nouvelle resténose après angioplastie au ballon ou
au rotablator complété par ballon pour resténose intrastent.
Succès Nouvelle
primaire revascularisation
pour resténose
T. Lefèvre (AHA 97) 100 % 17 %
B. Chevalier (AHA 98) 97 % 33 %
Tableau III. Taux de nouvelle revascularisation après angioplastie avec
second stent pour resténose intrastent.

La Lettre du Cardiologue - n° 307 - février 1999
8
INFORMATIONS
sont en cours d’évaluation chez l’homme. Dans l’étude WRIST,
l’irradiation intracoronaire par 192 Ir (15 Gy à 2 mm pendant
22 minutes) diminue de 61 % le taux de nouvelle revascularisa-
tion pour resténose.
CHIRURGIE MINI-INVASIVE
Les avantages et les inconvénients de la chirurgie mini-invasive
ont donné lieu à une controverse passionnante.
Avantages de la chirurgie mini-invasive
(P. Nataf)
Le développement depuis quatre ans de la chirurgie mini-inva-
sive répond à l’objectif qui consiste à diminuer l’agression chi-
rurgicale, en limitant l’incision cutanée, le délabrement tissulaire,
l’agression de la circulation extracorporelle (CEC) et du clam-
page aortique. Plusieurs techniques répondent à cet objectif : pon-
tage sans CEC (par sternotomie médiane ou minithoracotomie),
chirurgie valvulaire ou pontage sous CEC par petite incision,
robotique, télémanipulation, anastomoses mécaniques...
La qualité de l’anastomose lors du pontage sans CEC est amé-
liorée par l’utilisation d’un stabilisateur cardiaque (93 % à 99 %
de pontages perméables vs 62 % à 92 % en l’absence de stabili-
sateur). Le pontage coronaire à cœur battant peut être avanta-
geusement proposé en alternative à la CEC lorsqu’il existe des
calcifications aortiques importantes, une altération majeure de la
fonction ventriculaire gauche, une insuffisance respiratoire ou
rénale sévère, des troubles de l’hémostase. Le pontage sans CEC
est contre-indiqué en cas de coronaire intramyocardique, calci-
fiée, de diamètre < 1,5 mm. La qualité des résultats de cette tech-
nique est conditionnée par l’expérience du chirurgien (courbe
d’apprentissage), le retour aux techniques classiques en cas de
difficulté et la limitation des indications à l’artère interventricu-
laire antérieure ou la coronaire droite.
Limites de la chirurgie mini-invasive
(O. Bical)
L’enthousiasme pour la chirurgie mini-invasive s’estompe si l’on
analyse ses résultats en détail. Les petites incisions nécessitent
un étirement cutané, source de chéloïdes, compliquent la tech-
nique chirurgicale et limitent les purges gazeuses. Certains abords,
notamment en chirurgie valvulaire, peuvent léser les artères mam-
maires et compromettre une revascularisation coronaire ulté-
rieure. Les douleurs post-thoracotomie sont souvent importantes,
favorisées par l’étirement tissulaire et l’ablation de cartilage cos-
tal. La durée moyenne de séjour est peu différente (7 jours vs
10 jours en cas de chirurgie conventionnelle). Le temps d’occu-
pation de la salle d’opération est augmenté de 50 %. Le système
de CEC percutanée fémorale (système Heart-Port) permet, certes,
de limiter la taille de l’incision mais il expose à des complica-
tions vasculaires, à des difficultés techniques et à un coût élevé
(30 000 F par patient). L’utilisation d’un stabilisateur à usage
unique, indispensable au pontage sans CEC, alourdit le coût de
la procédure. Les taux de morbidité et de mortalité du pontage
sans CEC sont élevés dans les centres avec peu d’expérience
(technique absente en 1995, et actuellement réalisée dans
300 centres aux États-Unis), et beaucoup de chirurgiens ont
renoncé à cette technique. Le stress myocardique, évalué par
dosage de la troponine, est augmenté. Le taux de perméabilité
des pontages sans CEC est amélioré par l’utilisation d’un stabi-
lisateur, mais reste moins élevé qu’après pontage sous CEC, et
pour un patient en bon état général ayant plusieurs échecs d’an-
gioplastie, la qualité de l’anastomose coronaire l’emporte sur la
longueur de l’incision. Enfin, certaines artères sont inaccessibles
au pontage sans CEC (interventriculaire postérieure, rétroventri-
culaire postérieure ou marginale gauche).
Toutes ces limites ne doivent cependant pas faire arrêter la chi-
rurgie mini-invasive. Le pontage sans CEC est reproductible, évite
les phénomènes inflammatoires liés à la CEC, et peut être écono-
mique si l’on réutilise les stabilisateurs. Pour O. Bical, les indi-
cations du pontage sans CEC doivent être limitées aux patients
à haut risque de complication avec une chirurgie convention-
nelle (patients âgés, en mauvais état général, avec insuffisance
rénale). En 1998, O. Bical a ponté sans CEC 20 patients à haut
risque chirurgical (versus 400 patients pontés sous CEC pendant
la même période). Deux patients sont décédés (à un et deux mois),
les dix-huit autres ont des pontages perméables malgré deux sté-
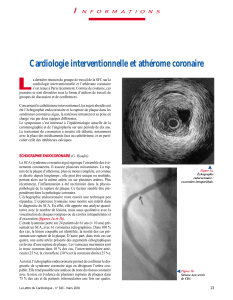
noses anastomotiques. La figure 1 illustre une sténose anastomo-
Figure 1.
Sténose ostiale coronaire droite ;
pontage sans CEC coronaire droite
par artère mammaire interne ;
sténose anastomotique
à la jonction mammaire interne -
segment 2 coronaire droite.

INFORMATIONS
tique après pontage sans CEC de la coronaire droite, lors d’un
contrôle motivé par une ischémie inférieure postopératoire.
Ce patient bénéficiera en extemporané d’une angioplastie de la
sténose ostiale de la coronaire droite (figure 2).
Par ailleurs, le développement de la chirurgie mini-invasive a per-
mis d’améliorer les techniques de chirurgie conventionnelle :
extubation précoce, limitation des transfusions, intervention en
normothermie, prélèvement mammaire squelettisé, écartement
sternal limité, prélèvement saphène sous vidéo, utilisation d’une
CEC la moins bio-incompatible possible pour éviter les phéno-
mènes inflammatoires réactionnels. ■
Figure 2. Angioplastie de la sténose ostiale de la coronaire droite avec mise en place d’un stent : la sténose passe de 58 % à 0 %.
Merci d’écrire nom et adresse en lettres majuscules
Dr, M., Mme, Mlle ...........................................................................
Prénom ..........................................................................................
Pratique : ❏hospitalière ❏libérale ❏autre..........................
Adresse..........................................................................................
......................................................................................................
Code postal ...................................................................................
Ville ................................................................................................
Pays................................................................................................
Tél..................................................................................................
Avez-vous une adresse E-mail : oui ❏non ❏
Sinon, êtes-vous intéressé(e) par une adresse E-mail : oui ❏non ❏
Merci de joindre votre dernière étiquette-adresse en cas de réabonnement,
changement d’adresse ou demande de renseignements.
Tarif 1999 / LC /
Bimensuel
ABONNEMENT FRANCE /
DOM-TOM et CEE
❐
1 an / 580 F
❐
2 ans / 940 F
❐
1 an / 290 F étudiants
joindre la photocopie de la carte
❐
+ 60 F par avion pour les DOM - TOM
ABONNEMENT ETRANGER / autre que CEE
❐
1 an / 720 F
❐
+ 190 F par avion
POUR RECEVOIR LA RELIURE
❐70 F avec un abonnement ou un réabonnement
❐140 F par reliure supplémentaire
(franco de port et d’emballage)
MODE DE PAIEMENT
❐
par carte Visa
N°
ou
Eurocard Mastercard
Signature : Date d’expiration
❐
par chèque
(à établir à l'ordre d'EDIMARK)
EDIMARK - 62-64, rue Jean-Jaurès - 92800 Puteaux
Votre abonnement prendra effet dans un délai de 3 à 6 semaines à réception de votre ordre.
Un justificatif de votre règlement vous sera adressé quelques semaines après son enregistre
ment.
ABONNEZ-VOUS!
ABONNEZ-VOUS!
À découper ou à photocopier
✁
Dans le cadre de la Formation Médicale Continue : ABONNEZ-VOUS !
1
/
4
100%