Septième réunion nationale du Groupe de réflexion sur la cardiologie interventionnelle I

La Lettre du Cardiologue - n° 345 - mai 2001
15
LES ANTI-GPIIb/IIIa : DU FONDAMENTAL
À LA PRATIQUE
(L. Drouet, Paris)
Initialement, la thrombose a un aspect macroscopique clair qui
correspond à l’agrégation des plaquettes, puis elle prend un aspect
rouge correspondant à la fibrine. Elle a pour conséquence la dimi-
nution du flux sanguin dans le vaisseau thrombosé.
Pour lutter contre la thrombose, on dispose à l’heure actuelle de
différents antiagrégants plaquettaires : l’acide acétylsalicylique,
le clopidogrel, les inhibiteurs des récepteurs aux GPIIb/IIIa. Les
plaquettes au contact du stent libèrent du thromboxane A2
(TX A2) et de l’adénosine diphosphate (ADP), à l’origine de la
création de ponts fibrinogènes. L’acide acétylsalicylique et le clo-
pidogrel inhibent respectivement chacune de ces voies. Cela a
pour effet de bloquer partiellement l’agrégabilité plaquettaire.
Pour couper tous les ponts fibrinogènes et obtenir une activité
antiagrégante maximale, il faut utiliser un inhibiteur des récep-
teurs aux GPIIb/IIIa.
Expérimentalement, on observe l’apparition d’un thrombus dans
un tube synthétique anastomosé à une veine. En renouvelant cette
expérience sous clopidogrel (les plaquettes sont alors peu acti-
vées), un thrombus lâche se forme. Sous abciximab, on n’observe
pas d’adhésion plaquettaire (ou une simple monocouche). En
effet, sous cette molécule, la réactivité plaquettaire est nulle. Son
corollaire est l’augmentation du risque hémorragique.
On dispose actuellement de trois molécules anti-GPIIb/IIIa uti-
lisables par voie intraveineuse : l’abciximab, l’eptifibatide, le tiro-
fiban. L’abciximab est un anticorps monoclonal qui présente une
très grande affinité aux récepteurs des GPIIb/IIIa. Sa concentra-
tion plasmatique est quasi nulle, puisqu’il se fixe presque exclu-
sivement sur les récepteurs de la membrane plaquettaire. Les deux
autres molécules ont une affinité beaucoup plus faible, et leur
concentration plasmatique est donc importante.
Une inhibition partielle de l’activité IIb/IIIa n’a pas d’intérêt.
Chez les sujets présentant un déficit de 50 % en GPIIb/IIIa (tel
qu’on peut l’observer chez les parents des patients présentant une
thrombasthénie de Glanzmann), l’hémostase est normale. Il est
nécessaire d’inhiber toute l’activité IIb/IIIa. En dépassant la dose
d’anti-GPIIb/IIIa nécessaire à une activité antiagrégante maxi-
male, on n’augmente évidemment pas l’effet.
Concernant l’utilisation de l’abciximab dans l’angor instable, il
semble qu’à quatre heures du bolus apparaît un peu d’agrégation
plaquettaire, suggérant que la dose de la perfusion d’abciximab
suivant le bolus serait un peu trop faible. L’administration d’ab-
ciximab provoque un changement de conformation du récepteur
de la GPIIb/IIIa. En cas de dose insuffisante, certains récepteurs
restent activés et confèrent une activité proplaquettaire. D’après
L. Drouet, un patient sur dix serait concerné par une dose de per-
fusion trop faible. Dans le modèle de la plaque rompue, inter-
viennent les plaquettes et la fibrine, justifiant l’association d’un
traitement antiplaquettaire et anticoagulant. La thrombose est un
système dynamique d’agrégation-désagrégation conduisant à
l’occlusion. Les molécules anti-GPIIb/IIIa empêchent la réagré-
gation plaquettaire et permettent ainsi d’interrompre le cycle
conduisant à l’occlusion coronaire.
INFORMATIONS
Septième réunion nationale
du Groupe de réflexion sur
la cardiologie interventionnelle
La septième réunion nationale du Groupe de
réflexion sur la cardiologie interventionnelle s’est
tenue, cet hiver, au palais des Congrès de Versailles.
Elle a réuni plus de 300 participants.
Cette journée s’organisait autour d’ateliers, de
conférences et de procédures d’angioplastie coro-
naire retransmises en direct depuis la salle de
cathétérisme du centre hospitalier André-Mignot, à
Versailles.
Cette session fut riche d’enseignements :
✔L. Drouet a fait le point sur le mode d’action et
l’utilisation des anti-GPIIb/IIIa ;
✔Les recommandations en termes de formation des
cardiologues interventionnels ont été rappelées par
J.L. Dubois-Randé (pour la Société française de car-
diologie) et P. Urban (pour la Société suisse de car-
diologie) ;
✔B. de Bruyne a fait une mise au point sur la phy-
siologie coronaire ;
✔Enfin le problème de la resténose coronaire et des
solutions actuelles à notre disposition a été traité par
P. Urban.

La Lettre du Cardiologue - n° 345 - mai 2001
16
Dans l’infarctus, l’association d’un thrombolytique aux anti-
GPIIb/IIIa semble être une solution, le thrombus étant maintenu
par de la fibrine. Un traitement associant une demi-dose de throm-
bolytique à de l’abciximab permet une action antithrombotique
meilleure pour un risque hémorragique non augmenté. Le béné-
fice de l’abciximab à la phase aiguë de l’infarctus n’a pas été
retrouvé dans l’angor instable.
Il existe un effet-dose dans l’utilisation des anti-GPIIb/IIIa, ce
qui a pu être vérifié dans l’étude TARGET (communication lors
du congrès 2000 de l’American Heart Association). Par contre,
il n’existe pas de surdosage en anti-GPIIb/IIIa. Une inhibition de
l’activité plaquettaire de 100 % est nécessaire.
La question de la place de ces molécules en dehors de la salle de
cathétérisme reste posée.
QUELLE FORMATION POUR LE CARDIOLOGUE INTER-
VENTIONNEL ?
(J.L. Dubois-Randé, Paris ; P. Urban, Genève,
Suisse)
La formation du cardiologue interventionnel fait intervenir plu-
sieurs paramètres, tels que l’activité personnelle, l’encadrement
ou l’évolution de la discipline.
Niveau d’activité et risque
Un volume de 400-600 angioplasties coronaires semble néces-
saire aux centres formateurs ; à partir de ces chiffres, on peut par-
ler d’“effet centre”. Le risque encouru par le patient est inverse-
ment proportionnel au niveau d’activité du centre. La mortalité
hospitalière après angioplastie, rapportée par Jollis et al., est de
2,5 % parmi les patients pris en charge dans les centres réalisant
le plus grand nombre d’angioplasties versus 3,9 % dans ceux pré-
sentant le plus bas volume (N Engl J Med 1994 ; 331 : 1625-9).
Les mêmes auteurs rapportent un taux de pontage aortocoronaire
après angioplastie de 2,8 % versus 5,3 %.
L’activité individuelle du médecin réalisant l’angioplastie a éga-
lement une incidence sur le nombre de complications post-pro-
cédure. Les angioplasticiens traitant moins de 70 patients par an
ont un taux global de complications graves de 9,3 % versus
1,7 à 2,9 % pour ceux traitant plus de 270 patients par an. Ainsi,
une activité individuelle annuelle inférieure à 70 angioplasties
semble insuffisante pour garantir une sécurité acceptable. Il faut
noter que le nombre de complications est également corrélé au
nombre de procédures à risque. Celles-ci sont effectuées par des
angioplasticiens ayant une activité importante.
L’expérience du groupe compense partiellement le manque d’ex-
périence individuelle. En revanche, une activité individuelle d’an-
gioplastie insuffisante n’est pas compensée par l’ancienneté de
cette pratique. Une phase d’apprentissage assez courte semble
être la plus adaptée aux modifications constantes et rapides de
cette technique ainsi que du matériel.
L’introduction du stent dans la pratique courante n’a pas modi-
fié les constatations concernant la relation entre le niveau d’acti-
vité et le risque de complications. Une activité annuelle supé-
rieure à 90 angioplasties est corrélée avec une diminution du
risque de complications (Kastrati et al., J Am Coll Cardiol 1999 ;
32 : 970-6).
Formation des cardiologues hémodynamiciens, coronaro-
graphistes et angioplasticiens
Tout cardiologue doit avoir effectué une formation de deux ans
sous forme d’un diplôme interuniversitaire. Celui-ci comporte un
enseignement théorique sur 2 ans, ainsi qu’une formation pratique
au cours de laquelle le praticien en formation devra réaliser :
– cinq cents coronarographies, dont 300 comme premier
opérateur,
– deux cent cinquante angioplasties, dont 150 comme premier
opérateur,
– cent implantations d’endoprothèse.
Les centres formateurs devront pratiquer plus de 600 angio-
plasties par an et disposer d’un ou plusieurs angioplasticiens ayant
un niveau d’activité supérieur à 200 angioplasties par an. Actuel-
lement, en France, 30 % des centres ont une activité supérieure
à 600 angioplasties par an.
On observe une moyenne de 2,7 centres par million d’habitants.
Les perspectives d’avenir de la cardiologie interventionnelle sont
un retour aux traitements médicamenteux (GUSTO IV), un dépla-
cement de l’activité vers l’urgence, l’évolution des techniques
concernant le traitement des lésions de bifurcations, la resténose,
les procédures de revascularisation combinée, la prise en charge
par les angioplasticiens de la pathologie vasculaire périphérique...
Recommandations de la Société suisse de cardiologie (SSC)
P. Urban a présenté les recommandations de la SSC concernant
la cardiologie interventionnelle : les angioplasticiens doivent avoir
un diplôme fédéral de médecine, cinq ans de formation clinique
(dont trois en cardiologie), un an de formation à la cardiologie
interventionnelle avec une activité de 200 coronarographies et
100 angioplasties. Une activité minimum de 50 angioplasties est
requise pour pratiquer la cardiologie interventionnelle. Les com-
pétences individuelles sont corrélées aux compétences du centre.
Ainsi, une activité de plus de 400 angioplasties et 800 coronaro-
graphies par an est requise pour les centres de cardiologie inter-
ventionnelle. Le centre doit disposer d’une unité de soins inten-
sifs, de deux installations de fluoroscopie, et il doit être possible
de mettre en place un ballon de contrepulsion intra-aortique. Les
centres de formation doivent pouvoir accueillir les patients
24 h/24. Les données relatives aux procédures d’angioplastie doi-
vent être collectées et transmises à la SSC sur support informa-
tique. Des audits de la SSC sont réalisés dans les centres.
LA PHYSIOLOGIE CORONAIRE POUR LE CARDIOLOGUE
INTERVENTIONNEL
(B. de Bruyne, Aalst, Belgique)
La physiologie coronaire fait intervenir des notions de conduc-
tance, se rapportant à la circulation épicardique, et de résistance,
se rapportant à la microcirculation coronaire. Une sténose coro-
naire peut être quantifiée grâce à l’étude des vélocités (réserve
coronaire) ou de la pression. Pour ce faire, il est nécessaire d’uti-
liser un guide doppler (comportant un crystal doppler à son
extrémité) ou un guide pression (comportant un capteur à son
extrémité).
La CFR (coronary flow reserve) correspond au rapport Vmax en
hyperhémie sur Vmax de base ; sa valeur normale est aux alen-
I
NFORMATIONS

tours de 4 à 6. Lors de sténoses coronaires significatives, elle est
inférieure à 2. Si le flux de base est anormalement haut, le rap-
port va être anormalement bas. Ainsi, la CFR sera d’autant plus
basse que la tension artérielle est élevée. Cela pose le problème
de la valeur normale de la CFR. Celle-ci varie en fonction de dif-
férents facteurs tels que la tension artérielle, l’âge... Une
CFR < 1,6 est forcément pathologique, une CFR > 2,5 est nor-
male. Il persiste une incertitude concernant les réserves coronaires
comprises entre 1,6 et 2,5. Or, cet intervalle correspond aux
lésions que l’on souhaite évaluer.
Une CFR diminuée peut être le témoin d’une sténose épicardique
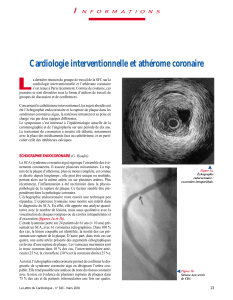
significative ou d’une maladie de la microcirculation (figures 1 à 3),
sans que l’on puisse préciser ce qui revient à l’une ou à l’autre des
pathologies. D’où l’intérêt de la FFR (fractional flow reserve), qui
correspond à un gradient de pression hyperhémique. Celui-ci varie
également avec la tension artérielle. La FFR correspond au rap-
port flux hyperhémique distal sur flux hyperhémique proximal
(Pd/Pa). Elle est exprimée en pourcentages et correspond au débit
coronaire à l’effort. Contrairement à la CFR, la FFR ne prend pas
en compte la microcirculation coronaire. Une FFR > 0,75
concorde avec l’absence d’ischémie sur les tests non invasifs. La
valeur normale est de 1. On note une diminution du gradient de
pression lorsqu’il existe une athérosclérose diffuse, malgré l’ab-
sence de toute lésion coronaire significative, ce qui
témoigne d’une
résistance anormale. Dans 8 % des cas on retrouve
une FFR < 0,75,
secondaire à de l’athérosclérose diffuse. Trente à 35 % de la résis-
tance totale est due à de l’athérosclérose diffuse. Cela explique la
présence de faux positifs des tests non invasifs de dépistage de
l’ischémie, secondaire à l’augmentation de la résistance artérielle
coronaire par athérosclérose coronaire diffuse.
La Lettre du Cardiologue - n° 345 - mai 2001
17
I
NFORMATIONS
Figure 1.
Ischémie myocardique latérale
chez un patient diabétique
asymptomatique.
Figure 2. Coronarographie normale chez ce même patient.
Figures 3a et 3b. Diminution relative de la réserve coronaire dans la Cx (CFR :
1,9)
par rapport à l’IVA (CFR : 2,5) témoignant d’une anomalie de la micro-
circulation coronaire.
3a
3b

La Lettre du Cardiologue - n° 345 - mai 2001
18
LA RESTÉNOSE CORONAIRE : LE POINT EN L’AN 2000
(P. Urban, Genève, Suisse)
La resténose coronaire est un phénomène limité dans le temps ;
elle survient dans les 6-12 mois suivant l’angioplastie. Elle est
secondaire à un remodelage élastique après angioplastie au bal-
lon. Il a été montré qu’après implantation d’un stent, le nombre
d’événements et le taux de resténose étaient abaissés par rapport
au groupe ayant bénéficié d’une angioplastie au ballon seul. Un
taux de stenting de 70 % est rapporté en Suisse pour l’année 1998.
La physiopathologie de la resténose intrastent est différente, elle
est secondaire à :
– l’hyperplasie néo-intimale,
– un rapport diamètre du stent sur diamètre de l’artère inférieur
à 1 (mauvaise expansion du stent) ;
– rarement, à un recul élastique du stent.
La resténose est focale dans 42 % des cas, diffuse intrastent dans
21 %, diffuse proliférative dans 30 % et occlusive dans 7 %.
Les facteurs de risque de resténose sont le diabète, la longueur
du stent et le MLD final.
Quelles solutions au problème de la resténose ?
D’après Mehran et al. (Circulation 1999 ; 100 : 1872-78), le tar-
get vessel revascularization à un an après traitement d’une resté-
nose intrastent est de 19 % pour les resténoses intrastent infé-
rieures à 10 mm, de 35 % pour les resténoses > 10 mm ne
dépassant pas les limites du stent, de 50 % pour les resténoses
prolifératives et de 83 % pour les occlusions.
D’après l’étude ARTIST, l’angioplastie intrastent reste supérieure
au Rotablator, avec 9 % d’événements versus 20 % à 8 mois. Le
laser présente des résultats semblables à ceux du Rotablator.
Le traitement de la resténose intrastent par stent est émaillé d’un
taux de resténose de 30%.
Le cutting balloon présenterait peu de complications et, d’après
Chevalier et al., on note un taux de resténose de 12 % avec le
cutting balloon versus 20 % avec le ballon simple.
La brachythérapie semble diminuer la resténose de façon signi-
ficative. Elle nécessite certaines précautions : la réalisation d’une
seule inflation (diminution du barotraumatisme, absence de “geo-
graphical miss”). Il semble cependant que la brachythérapie
expose à des thromboses tardives (< 30 jours), avec un taux de
thrombose intrastent de 6,7 % versus 0,7 % (en absence d’irra-
diation). Ce taux de thrombose en l’absence de stent est de 1,4 %
versus 1,2 % (en absence d’irradiation). L’augmentation du risque
de thrombus est secondaire à la diminution de l’endothélialisa-
tion provoquée par l’irradiation coronaire. L’étude SCRIPPS 3 uti-
lisant un rayonnement gamma montre l’intérêt d’un traitement
par Aspegic®et clopidogrel pendant 6 à 12 mois (0 % de throm-
bus tardif, 1,4 % d’occlusion silencieuse).
Un suivi à 3 ans semble indiquer que la brachythérapie retarde la
resténose. En effet, on observe une diminution du MLD à 6 mois
qui se poursuit à 3 ans après brachythérapie, alors que le MLD
se stabilise à 6 mois après angioplastie sans radioactivité.
Pour éviter le problème du “geographical miss”, la zone irradiée
doit être inférieure au barotraumatisme.
L’indication préférentielle de la brachythérapie semble être la
resténose intrastent. Il persiste quelques imprécisions telles que
la dose optimale de radioactivité, le traitement antiagrégant et sa
durée.
Il n’y a pas d’intérêt à l’utilisation des anti-GPIIb/IIIa dans le trai-
tement de la resténose coronaire.
Il reste à définir la place des coated stents, dont les résultats pré-
liminaires évoquent un taux de resténose de 0 %.
En pratique, la resténose est devenue rare depuis l’implantation
de stent. La brachythérapie semble constituer la meilleure solu-
tion pour le traitement de la resténose diffuse intrastent. Il est
nécessaire d’effectuer une sélection des patients en fonction du
rapport bénéfice du stent et risque de resténose, afin de ne pas
implanter un stent de manière systématique si l’indication n’est
pas formelle. Le coated stent pourrait représenter à l’avenir une
solution au problème de la resténose.
O. Barthélémy, clinique cardiologique,
hôpital Necker, Paris
I
NFORMATIONS
Les articles publiés dans “La Lettre du Cardiologue”
le sont sous la seule responsabilité de leurs auteurs.
Tous droits de reproduction, d'adaptation
et de traduction par tous procédés
réservés pour tous pays.
© mai1983 - EDIMARK S.A.
Imprimé en France - Differdange S.A. - 95110 Sannois
Dépôt légal 2etrimestre 2001
1
/
4
100%