Étude FIRE-3 : les raisons d’un échec d’une étude comparant deux schémas

486 | La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013
L’
étude FIRE-3 a parcouru l’année 2013 en égre-
nant ses résultats dans 3 congrès : congrès
américain en oncologie clinique (Chicago),
résultats pour la population wtKRAS (exon 2)
[1] ; WCGIC (Barcelone), traitements délivrés en
deuxième ligne (2) ; ESMO (Amsterdam), restriction
des paramètres d’effi cacité à la population wtRAS
(KRAS, NRAS exons 2,3,4) [3].
La comparaison directe de 2 standards, FOLFIRI-
cétuximab et FOLFIRI-bévacizumab, mais aussi
l’étrangeté des résultats sont les raisons d’un succès
2013 pour l’étude FIRE-3. L’oncologue, pour autant,
est-il soumis à un changement des pratiques ?
Feu vert pour l’étude
FIRE-3 : un taux
de réponses objectives
(RO) et une médiane
de survie sans progression
(SSP) identiques ; une toxicité
majorée avec FOLFIRI-
cétuximab ; une ineffi cacité
du cétuximab pour les tumeurs
RAS muté
Le taux de RO, en intention de traiter, est de 65,5 %
(FOLFIRI-cétuximab) versus 59,6 % (FOLFIRI-
bévacizumab) pour la population wtRAS (2).
La différence n’est pas signifi cative (tableau IA).
Les autres composantes de la réponse n’ont été
communiquées que pour la population wtKRAS
exon 2 (1). Le taux de stabilité est statistiquement
en faveur de FOLFIRI-bévacizumab (28,8 % versus
17,5 %). Le taux de réponses complètes, faible dans
les 2 bras est à l’avantage de FOLFIRI + cétuximab
(4,4 % versus 1,4 %) (tableau IB). Au total, le taux
de contrôle de la maladie (taux de RO + stabilité),
non précisé par les auteurs, est supérieur dans le
bras FOLFIRI + bévacizumab (79,5 % – 237 patients
– versus 86,8 % – 256 patients).
Les courbes de SSP sont strictement superposables
avec des médianes identiques (tableau IA). Il existe
un plateau à 10 mois, quelle que soit la combinaison
bi-chimiothérapie + thérapeutique ciblée utilisée
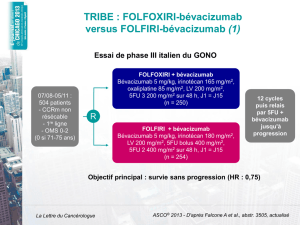
(tableau II) [4-6]. Dans l’étude TRIBE, c’est l’ajout
d’un cytotoxique (oxaliplatine) qui permet de franchir
cet obstacle avec une médiane de SSP de 12,2 mois
pour FOLFOXIRI + bévacizumab versus 9,7 mois pour
FOLFIRI + bévacizumab (HR = 0,73 ; IC
95
: 0,60-0,88)
[tableau IIC].
L’étude FIRE-3 confi rme les toxicités totalement diffé-
rentes des 2 combinaisons. Elles ne sont décrites que
pour la population wtKRAS (tableau III) [1]. Il est
retenu, quel que soit le grade, plus de nausées (62,4 %
versus 48,2 %), de vomissements (32,9 % versus
24,6 %), de saignements (28,5 % versus 21,2 %),
d’abcès/fi stule (5,4 % versus 1,4 %), et d’hyperten-
sion artérielle (38,3 % versus 21,2 %) avec FOLFIRI +
bévacizumab (tableau III). Pour ces événements, les
différences s’annulent pour les toxicités grade 3/4,
en particulier l’hypertension artérielle (6,4 % versus
6,8 %) et les saignements (0,7 % versus 0,3 %).
Étude FIRE-3 : les raisons
d’un échec d’une étude
randomisée de phase III
comparant deux schémas
effi caces dans les cancers
colorectaux métastatiques
J. Bennouna*
* Institut de cancérologie de l’Ouest, Nantes-Angers.
CONTROVERSE
CONTRO

La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013 | 487
Inversement, les toxicités cutanées, quel que soit
le grade sont nettement aggravées avec FOLFIRI +
cétuximab. Une attention plus importante doit être
portée à l’hypocalcémie et à l’hypomagnésémie
en cas de prescription de FOLFIRI + cétuximab.
Le tableau III ne mentionne pas la protéinurie
(2,7 % versus 2,0 %), les perforations gastro-
intestinales (0,3 versus 0,7 %), et les événements
thrombo emboliques (7,4 % versus 7,1 %) en raison
de l’absence de différence entre les 2 bras. Alors
que largement connues pour le bévacizumab, les
complications thromboemboliques font aussi
partie du cortège des effets secondaires des anti-
EGFR. En 2011, une méta-analyse de 13 études
(7 611 patients) a rapporté des risques thrombo-
emboliques veineux majorés avec le cétuximab et
le panitumumab (RR = 1,34 ; p = 0,01) [7].
FIRE-3 confi rme la totale ineffi cacité, voire l’action
délétère de FOLFIRI + cétuximab pour les tumeurs
exprimant le statut RAS muté (KRAS, NRAS
exons 2,3,4), soit 50 % des CCRm. C’est le début
de la médecine de précision, plus tard guidée par le
développement des “omics” et resserrant le champ
d’activité des anticorps anti-EGFR. Le bévacizumab,
par son action sur le micro-environnement tumoral,
en particulier les cellules endothéliales génétique-
ment stables possède une action plus large combinée
au choix de la chimiothérapie par l’oncologue.
CO O
VERSE
Tableau I. Première ligne de traitement des CCRm – Résultats de l’étude FIRE-3.
A. Paramètres d’effi cacité – Statut wtRAS – ESMO 2013.
FOLFIRI + cétuximab FOLFIRI + bévacizumab HR
n171 171
Taux de RO 65,5 % 59,6 % p = 0,32
Médiane de SSP 10,4 mois 10,2 mois 0.93 (0.74 – 1.17)
Médiane de SG 33,1 mois 25,6 mois 0.70 (0.53 – 0.92)
B. Évaluation de la réponse – Statut wtKRAS exon 2 – Congrès américain en oncologie clinique 2013.
RECIST FOLFIRI + cétuximab FOLFIRI + bévacizumab
n297 295
Taux de RC 13 (4,4 %)* 4 (1,4 %)*
Taux de RP 171 (57,6 %) 167 (56,6 %)
Stabilité 53 (17,5 %)* 85 (28,8 %)*
Progression 21 (7,1 %) 16 (5,4 %)
Non évaluable 39 (13,1 %) 23 (7,8 %)
* Différence signifi cative pour la réponse.
NB : le taux de contrôle de la maladie dans le bras FOLFIRI-cétuximab est de 79,5 % (237 patients) versus 86,8 % (256 patients).
Tableau II. Première ligne de traitement des CCRm – Études CRYSTAL, PRIME et TRIBE.
A. Étude CRYSTAL – Statut wtKRAS exon 2.
FOLFIRI FOLFIRI + cétuximab HR
n350 316
Taux de RO 39,7 % 57,3 % p < 0,001
Médiane de SSP 8,4 mois 9,9 mois 0,696 (0,558 – 0,867)
Médiane de SG 20,0 mois 23,5 mois 0,796 (0,670 – 0,946)
B. Étude PRIME – Statut wtRAS exon 2.
FOLFOX4 FOLFOX4 + panitumumab HR
n259 253
Taux de RO ---
Médiane de SSP 7,9 mois 10,1 mois 0,72 (0,58 – 0,90)
Médiane de SG 20,2 mois 26 mois 0,78 (0,62 – 0,99)
C. Étude TRIBE – Statut RAS non déterminé.
FOLFIRI + bévacizumab FOLFIRINOX + bévacizumab HR
n256 252
Taux de RO 53 % 65 % 0,006
Médiane de SSP 9,7 mois 12,2 mois 0,73 (0,60 – 0,88)
Médiane de SG 25,8 mois 31 mois 0,83 (0,66 – 1,05)

488 | La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013
Feu orange pour l’étude
FIRE-3 : de multiples
imprécisions et le choix
d’un objectif principal
discutable
Au cours des 3 présentations de l’étude FIRE-3, de
nombreuses imprécisions peuvent être signalées.
Elles sont résumées ci-dessous.
➤ Congrès américain en oncologie clinique 2013 -
Imprécision sur le nombre de patients non évaluables
pour la réponse : exclusion de 66 patients dans
le tableau “diagramme des inclusions” versus
62 patients dans le tableau “évaluation des réponses”.
➤ ESMO 2013 – Imprécision entre le “Late-Break ing
Abstract” (LBA) et la présentation orale : 334 versus
342 tumeurs wtRAS.
➤ ESMO 2013 – Imprécision ou manquement de la
comparaison des caractéristiques démographiques
des 2 groupes de traitement (tumeurs wtRAS). Elles
sont uniquement décrites pour la population globale
évaluée pour RAS (407 patients) et comparées à la
population wtKRAS (592 patients). Un déséquilibre
des caractéristiques des patients entre les 2 groupes
(avec une tumeur wtRAS) ne peut être exclu.
Peut-être ont-elles peu ou pas de conséquences sur
les résultats de l’étude. Elles soulignent cependant
qu’avant publication fi nale, les résultats doivent être
interprétés avec certaines réserves.
Le choix du taux de RO comme objectif principal est
discutable, voire largement critiquable. Retenons
comme publié dans le LBA de l’ESMO 2013 (popula-
tion wtRAS) la différence signifi cative du taux de RO
(76 % versus 65,2 % ; p = 0,026) en ne considérant
que les patients évaluables pour la réponse (n = 301).
Le critère RECIST est une évaluation simple et facile
de la réponse au traitement. Il obère cependant tota-
lement les réponses morphologiques spécifi ques
au bévacizumab (densité de la tumeur, interface
tumeur foie sain, halo périphérique tumoral) [8].
Ces réponses morphologiques sont corrélées à la
SG, à l’inverse des critères RECIST.
Si l’augmentation des réponses a pour objectif un
plus grand nombre de chirurgie des métastases,
et donc plus de guérisons, alors seuls les patients
avec une maladie métastatique potentiellement
opérable doivent être inclus. C’est l’exemple de
l’étude OLIVIA qui comparait FOLFOX6 + bévaci-
zumab à FOLFOXIRI + bévacizumab (9) ou de l’étude
METHEP2/PRODIGE14 conduite actuellement en
France. La question même de l’intérêt d’une étude
randomisée de phase III, incluant 592 patients, ayant
pour objectif principal le taux de RO sans défi nir au
préalable une population de patients avec une maladie
métastatique potentiellement opérable est posée.
Feu rouge pour l’étude
FIRE-3 : l’analyse
de la survie globale
et l’oubli des traitements
de maintenance
et des stratégies multilignes
La médiane de SG est de 33,1 mois pour FOLFIRI-
cétuximab et de 25,6 mois pour FOLFIRI-bévaci-
zumab (tableau IA) [3]. Plus intrigant, les courbes
de SG, solidaires au-delà de la médiane de SSP,
divergent progressivement à 12 mois et l’éloigne-
ment devient effectif après 18 mois. À ce moment,
la majorité des patients restant échappent à une
Références
bibliographiques
1. Heinemann V, von Weikersthal LF,
Decker T et al. Randomized compa-
rison of FOLFIRI plus cetuximab
versus FOLFIRI plus bevacizumab as
fi rst-line treatment of KRAS wild-type
metastatic colorectal cancer: German
AIO study KRK-0306 (FIRE-3).
J Clin Oncol 2013;(Suppl.; abstr.
LBA3506).
2. Modest D, von Weikersthal
LF, Stintzing S et al. FOLFIRI plus
cetuximab versus FOLFIRI plus
bevacizumab as first-line treat-
ment of KRAS-wildtype metastatic
colorectal cancer German AIO study
KRK-0306 (FIRE-3). WCGIC 2013;
(abstr. O-0029).
3. Stintzing S, Jung A, Rossius L et al.
Analysis of KRAS/NRAS and BRAF
mutations in FIRE-3: a randomized
phase III study of FOLFIRI plus
cetuximab or bevacizumab as fi rst-
line treatment for wild-type (WT)
KRAS (exon 2) metastatic colorectal
cancer (mCRC) patients. ESMO 2013;
(abstr. LBA17).
4. Van Cutsem E, Köhne CH, Láng I et
al. Cetuximab plus irinotecan, fl uoro-
uracil, and leucovorin as first-line
treatment for metastatic colorectal
cancer: updated analysis of overall
survival according to tumor KRAS and
BRAF mutation status. J Clin Oncol
2011;29(15):2011-9.
5. Douillard JY, Oliner KS, Siena S
et al. Panitumumab-FOLFOX4
treatment and RAS mutations in
colorectal cancer. N Engl J Med 2013;
369(11):1023-34.
6. Falcone A, Cremolini C, Masi G et
al. FOLFOXIRI/bevacizumab (bev)
versus FOLFIRI/bev as first-line
treatment in unresectable metastatic
colorectal cancer (mCRC) patients
(pts): results of the phase III TRIBE
trial by GONO group. J Clin Oncol
2013;(Suppl.; abstr. 3505).
7. Petrelli F, Cabiddu M, Borgonovo K,
Barni S. Risk of venous and arterial
thromboembolic events associated
with anti-EGFR agents: a meta-
analysis of randomized clinical trials.
Ann Oncol 2012;23(7):1672-9.
8. Chun YS, Vauthey JN, Boonsirikam-
chai P et al. Morphologic criteria with
pathologic response and survival in
patients treated with bevacizumab
for colorectal liver metastases. JAMA
2009;302(21):2338-44.
9. Bridgewater J, Adam R, Chau P et
al. Updated effi cacy/safety fi ndings
from a randomized, phase 2 study
of bevacizumab plus mFOLFOX6 or
FOLFOXIRI in patients with initially
unresectable liver metastases from
colorectal cancer (OLIVIA study).
ESMO 2013;(abstr. 2159).
Tableau III. Évaluation des toxicités – Étude FIRE-3 – Statut wtKRAS exon 2 – Congrès américain en oncologie clinique 2013.
Seules sont indiquées les différences signifi catives entre les 2 bras.
FOLFIRI + cétuximab (n=297) FOLFIRI + bévacizumab (n=295)
nTous grades Grade ≥ 3 Tous grades Grade ≥ 3 p ≥ grade 3
Toxicités majorées pour la combinaison FOLFIRI + bévacizumab
Nausées 48,2 % 3,4 % 62,4 % 4,8 % 0,414
Vomissements 24,6 % 2,4 % 32,9 % 3,4 % 0,473
Hypertension 21,2 % 6,4 % 38,3 % 6,8 % 0,870
Saignements 21,2 % 0,7 % 28,5 % 0,3 % 0,498
Abcès/fi stule 1,4 % 0,3 % 5,4 % 1,0 % 0,372
Toxicités majorées pour la combinaison FOLFIRI+ cétuximab
Syndrome pieds-mains 26,6 % 3,4 % 14,2 % 0,7 % 0,037
Syndrome acnéiforme 77,4 % 16,8 % 7,8 % 0,0 % < 0,0001
Desquamation 35,4 % 6,7 % 11,5 % 0,7 % 0,0001
Paronychies 37,4 % 5,7 % 9,2 % 0,0 % < 0,0001
Réaction allergique 7,7 % 4 % 0,0 % 0,0 % 0,007
Hypocalcémie 27,6 % 4 % 15,3 % 2,4 % 0,351
Hypomagnésémie 63,3 % 4,4 % 39,7 % 0,7 % 0,007

La Lettre du Cancérologue • Vol. XXII - n° 11 - décembre 2013 | 489
deuxième ligne de traitement. Est-ce l’effet de la
troisième ligne de traitement qui pourrait expliquer
cette différence ? La réponse est impossible sans
information sur les traitements de troisième ligne.
La médiane de SSP est un marqueur de substitution
de la SG, ou “surrogate endpoint” des Anglo-Saxons.
Il a été validé dans les CCRm par l’établissement d’un
coeffi cient de corrélation entre SSP et SG (10-12).
Reconnaître la médiane de SSP comme objectif
principal possède de nombreux avantages facili-
tant la faisabilité de l’étude (nombre plus faible de
patients, moindre suivi) et éliminant l’impact des
lignes ultérieures sur la SG.
Le choix de la SG comme objectif principal peut
perdre de sa pertinence au moment de l’analyse
des résultats lorsque les standards thérapeutiques
se sont éventuellement modifi és et n’ont pu être
introduits dans l’étude au bénéfi ce des patients (10).
Ce dernier point est crucial. Deux études récentes
proposent de nouvelles stratégies thérapeutiques
dans les CCRm.
➤ La poursuite du bévacizumab en deuxième
ligne après progression avec switch de chimio-
thérapie améliore la SG de 9,8 mois à 11,2 mois
(HR = 0,81 ; IC95 : 0,69-0,94 ; p = 0,0062) et la SSP
de 4,1 mois à 5,7 mois (HR = 0,68 ; IC95 : 0,59-0,78 ;
p = 0,0001) [13]. Pour les patients avec une tumeur
wtKRAS, le bénéfi ce du continuum bévacizumab
en première et deuxième lignes métastatiques est
majeur avec une médiane de SG de 15,4 mois versus
11,1 mois (HR = 0,69 ; IC
95
: 0,53-0,90 ; p = 0,0052)
et une médiane SSP de 6,4 mois versus 4,5 mois
(HR = 0,61 ; IC95 : 0,49-0,77 ; p < 0,0001) [14].
➤ L’étude CAIRO3 valide le concept de la main-
tenance par capécitabine + bévacizumab par
comparaison à un arrêt thérapeutique avec une
augmentation de la médiane de SSP de 4,1 à 8,5 mois
(HR = 0,44 ; IC
95
: 0,37-0,53) déterminée après
6 cycles de capécitabine + oxaliplatine + bévaci-
zumab (15).
Dans l’étude FIRE-3, les médianes de traitement
par FOLFIRI-bévacizumab et FOLFIRI-cétuximab
sont de 5,3 mois et 4,8 mois. Ces durées sont rela-
tivement courtes, en particulier pour le bras avec
bévacizumab. Pour le bras FOLFIRI-cétuximab, la
poursuite du traitement est contrainte par les toxi-
cités cutanées et des phanères des anticorps anti-
EGFR (tableau III). Il est probable que les patients
inclus dans le bras FOLFIRI-bévacizumab n’ont pas
de reçu de traitement d’entretien par capécitabine
plus bévacizumab, et un petit nombre d’entre eux a
été traité selon la stratégie TML (11,5 % des patients
avec un statut wtKRAS ont reçu en deuxième ligne
une combinaison fl uoropyrimidine + oxaliplatine +
bévacizumab). Plus qu’un déséquilibre dans les lignes
ultérieures (sous réserve des troisièmes lignes admi-
nistrées), il s’agit d’un défaut de stratégie optimale
dans le bras avec bévacizumab.
Éliminant le rôle des lignes ultérieures, les
auteurs ont évoqué la profondeur de la réponse
et la réponse tumorale précoce comme facteur
prédictif de la SG. Cette hypothèse a été formulée
lors d’une analyse groupée des études CRYSTAL et
OPUS (16, 17). Il existe une forte valeur prédictive
de ces 2 paramètres pour la SG, mais aussi pour
la SSP. La même conclusion avec les mêmes para-
mètres est applicable à FOLFOXIRI plus bévaci-
zumab versus FOLFIRI + bévacizumab dans l’étude
TRIBE (18). Retenir l’argument de l’intensité de la
profondeur de la réponse tumorale pour expliquer
les résultats de l’étude FIRE-3 ne serait justifié que
si l’augmentation de la SG s’accompagnait d’une
meilleure SSP.
En conclusion
L’oncologue n’est pas soumis avec les résultats de
l’étude FIRE-3 à un changement des pratiques. Les
paramètres d’effi cacité, taux de RO selon les critères
RECIST, et médiane de SSP sont identiques pour
les patients un CCRm wtRAS traités par FOLFIRI-
cétuximab ou FOLFIRI-bévacizumab.
L’augmentation apparente de la médiane de SG
avec FOLFIRI-cétuximab dans l’étude FIRE-3 doit
s’accompagner de l’analyse des points suivants :
➤ séparation des courbes de SG au-delà de 18 mois
sans description des traitements de troisième ligne ;
➤ absence de traitement de maintenance dans le
bras FOLFIRI-bévacizumab ;
➤ faible proportion de patients traités selon la
stratégie TML.
La controverse peut s’arrêter là. FOLFIRI-cétuximab
et FOLFIRI-bévacizumab, avec des profi ls de toxi-
cité différents, sont 2 traitements à l’efficacité
comparable, sous réserve d’une stratégie post-
première ligne bien défi nie et optimale. Il est urgent
d’attendre les résultats de l’étude CALGB 80405
dont l’objectif principal est la SG avec environ
1 200 patients inclus. ■
J. Bennouna déclare avoir des liens d’intérêts avec Roche.
10. Sidhu R, Rong A, Dahlberg D.
Evaluation of progression-free
survival as a surrogate endpoint
for survival in chemotherapy and
targeted agent metastatic colorectal
cancer trials. Clin Cancer Res
2013;19(5):969-76.
11. Korn RL, Crowley JJ. Overview:
progression-free survival as an
endpoint in clinical trials with solid
tumors. Clin Cancer Res 2013;
19(10);2607-12.
12. Giessen C, Laubender RP,
Ankerst DP et al. Progression-free
survival as a surrogate endpoint for
median overall survival in meta-
static colorectal cancer: literature-
based analysis from 50 randomized
first-line trials. Clin Cancer Res
2013;19(1):225-35.
13. Bennouna J, Sastre J, Arnold D
et al. Continuation of bevacizumab
after fi rst progression in metastatic
colorectal cancer (ML18147): a
randomised phase 3 trial. Lancet
Oncol 2013;14(1):29-37.
14. Kubicka S, Greil R, André T et al.
Progression in patients with meta-
static colorectal cancer previously
treated with bevacizumab plus
chemotherapy: ML18147 study KRAS
subgroup fi ndings. Ann Oncol 2013.
Ann Oncol 2013;24(9):2342-9.
15. Punt CJA, Simkens LHJ, May A et
al. Updated results including quality
of life of the phase III CAIRO3 study of
the Dutch Colorectal Cancer Group
(DCCG): maintenance treatment
with capecitabine and bevacizumab
versus observation after induction
treatment with chemotherapy and
bevacizumab in metastatic colorectal
cancer (mCRC). ESMO 2013;(abstr.
2166).
16. Mansmann UR, Sartorius U,
Laubender RP et al. Deepness of
response: a quantitative analysis
of its impact on post-progression
survival time after fi rst-line treatment
in patients with mCRC. J Clin Oncol
2012;(Suppl. 34; abstr. 427).
17. Piessevaux H, Buyse M,
Schlichting M et al. Use of early
tumor shrinkage to predict long-term
outcome in metastatic colorectal
cancer treated with cetuximab. J Clin
Oncol 2013;31(30):3764-75.
18. Cremolini C, Loupakis F, Anto-
niotti C, et al. Assessing tumor
response beyond RECIST criteria:
early tumor shrinkage (ETS) and
deepness of response (DpR) in
phase III TRIBE trial by the GONO
group. ESMO 2013;(abstr. 2180).
CONTROVERSE
1
/
4
100%