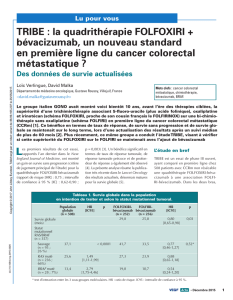
en néo-adjuvant dans le cancer colorectal métastatique

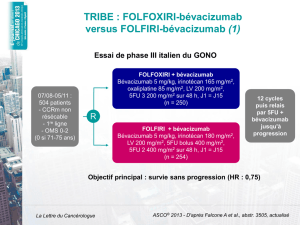
FOLFOXIRI en néo-adjuvant dans les cancers colorectaux métastatiques
Phase III : FOLFIRI (122 patients) - FOLFOXIRI (122 patients) multicentrique 15 centres
Critères d’inclusion (11/2001 à 04/2005):
Patients de 18 à 75 ans ( âge moyen 63 ans)
PS 0 à 2 si < 70 ans et PS 0 si age entre 71 et 75 ans (<5% de PS 2)
Adénocarcinome colorectal métastatique non résécable (70% colon 30% rectum)
Chimiothérapie adjuvante antérieure possible par fluoropyrimidine si terminée > 6 mois (24%)
maladie métastatique mesurable (critères WHO)
biologie: GB>3500/mm3 PN>1500/mm3 plaq>100000/mm3 créat≤1.3mg/dl bili<1.5mg/dl
transaminases et phosp alc ≤2.5N (≤5N si métastases hépatiques) (32% métastases hépatiques isolées)
Critères d’exclusion :
Chimiothérapie palliative antérieure pour maladie métastatique
Ayant reçu antérieurement irinotecan ou oxaliplatine
cardiopathie symptomatique, infarctus du myocarde <2 ans, arythmie non controlée
Infection en cours, maladie inflammatoire du tube digestif, colectomie totale
Modalités du traitement : (avec évaluation toutes les 8 semaines pour un maximum de 12 cycles)
J1=J15
Bras A : FOLFIRI avec irinotécan 180 mg/m2 sur 1h à J1
I-LV 100 mg/m2 sur 2 h à J1 et J2
5FU 400 mg/m2 en bolus sur 2 h à J1 et J2
5FU 600 mg/m2 en perfusion continue sur 22h à J1 et J2
Bras B : FOLFOXIRI avec irinotécan 165 mg/m2 sur 1h à J1
oxaliplatine 85 mg/m2 sur 2h à J1
I-LV 200 mg/m2 sur 2 h à J1
5FU 3200 mg/m2 en perfusion continue sur 48h
Critères de réponse : 1aire : taux de réponse (PFS)
2aires : survie globale (OS), survie sans progression (PFS),
taux de résection chirurgicale R0 post-chimiothérapie, toxicité et qualité de vie
Toxicité :
Interruption traitement en raison toxicité: Bras A 4% et Bras B 9%; aucun décès toxique
Bras A : 51% toxicité grade 3-4 dont 28% de neutropénies (3% fébrile) et 12% de diarrhée grade 3-4
Bras B : 90% toxicité grade 3-4 dont 50% de neutropénies (5% fébrile), 20% de diarrhée et 2% de
neurotoxicité grade 3-4
Résultats de l’essai:
Chirurgie radicale R0 post-chimiothérapie: 15% Bras B versus 6% Bras A
et dans sous-groupe limité aux métastases hépatiques isolées : 36% Bras B versus 12% Bras A
Survie sans progression: 9.8 mois Bras A et 6.9 mois Bras B
Avec un suivi médian de 18.4 mois, survie globale (OS) de 22.6 mois Bras B versus 16.7 mois Bras A
Commentaires sur l’essai :
L'évaluation de l'absence de résécabilité métastatique initiale n'a pas été centralisée
Intérêt réel d'un FOLFOXIRI en néo-adjuvant en cas de non résécabilité limite surtout si
localisations hépatiques isolées chez un patient jeune PS 0 ou 1 (mieux que FOLFIRI ou FOLFOX)
Questions sans réponses pour l'instant:
Comparaison FOLFOXIRI versus FOLFOX (ou FOLFIRI) +AVASTIN ?
Comparaison FOLFOXIRI versus FOLFOX (ou FOLFIRI) +ERBITUX ?
Comparaison FOLFOXIRI versus FOLFOXIRI +ERBITUX (ou AVASTIN) ?
Références :
Phase III trial of FOLFOXIRI compared with FOLFIRI as first-line treatment for metastatic colorectal
cancer: the Gruppo Oncologico Nord Ovest. Journal of Clinical Oncology 2007; 25:1670-1676
1
/
1
100%

![Bilan du projet [nom du projet]](http://s1.studylibfr.com/store/data/003403283_1-d079e3b3885251d9784bfab700f29504-300x300.png)