Tumeur urothéliale et cancer colique dans le cadre d`un

CAS CLINIQUE Progrès en Urologie (2000), 10, 1204-1207
1204
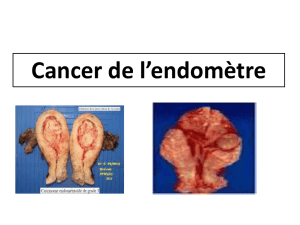
Tumeur urothéliale et cancer colique dans le cadre d’un syndrome
de prédisposition héréditaire au cancer colique HNPCC
Alexandre de la TAILLE(1, 2), Christophe MARIETTE (1), Marie-Pierre BUISINE (3),
Jacques BISERTE (2), Jean-Pierre TRIBOULET (1)
(1) Service de Chirurgie Viscérale, (2) Service de Chirurgie Urologique, (3) Laboratoire de Biochimie et de Biologie Moléculaire,
Hôpital Claude Huriez, Lille, France
Les tumeurs de l'uretère et du bassinet sont des tumeurs
peu fréquente dans la pratique chirurgicale quotidienne
(incidence estimée à 2 cas par an et pour 100 000 habi-
tants [10]). Parfois, ces tumeurs s'associent à des anté-
cédents familiaux de cancers en particulier recto-
coliques, et peuvent être inclues dans le cadre de mala-
die héréditaire. Le cancer recto-colique héréditaire non
polypoïde (HNPCC pour Hereditary NonPolyposis
Colorectal Cancer, ou syndrome de Lynch) représente
5% à 13% de l’ensemble des cancers colo-rectaux dia-
gnostiqués chaque année en France et est le premier
grand syndrome de prédisposition héréditaire au cancer
recto-colique (la polypose adénomateuse familiale
vient en seconde position avec 1% des cancers colo-
rectaux) [7, 9, 11]. Le syndrome HNPCC (critères
modifiés d’Amsterdam) associe au sein d’une même
famille des tumeurs du colon à des cancers d’autres
sites en particulier hépatobiliaires, de l’endomètre, de
l’ovaire, de l’estomac, de l'intestin grêle ou de la voie
excrétrice urinaire.
Nous présentons le cas d’un patient atteint d’une
tumeur colique entrant dans le syndrome HNPCC
(critères modifiés d'Amsterdam) chez qui a été
découvert une tumeur de la voie excrétrice supérieu-
re. Après avoir repris la définition clinique et géné-
tique du syndrome HNPCC, nous discutons l'intérêt
de la recherche de mutations et le bien-fondé d'un
dépistage des tumeurs urothéliales chez les patients
HNPCC et la recherche de tumeurs coliques chez les
patients atteints de tumeur de la voie excrétrice supé-
r i e u r e .
OBSERVATION
Dans les antécédents familiaux de A.C., un frère décé-
dé à 38 ans d'un adénocarcinome colique, un père décé-
dé à 67 ans d'un adénocarcinome rénal et un oncle
décédé à 93 ans d'une tumeur de la voie excrétrice uri-
naire. Il présente un tabagisme très modéré à 10
paquets/années. A l'âge de 47 ans, une coloscopie réa-
lisée pour un méléna permet le diagnostic de 2 lésions
suspectes sigmoïdiennes. Il bénéficie d'une rectosig-
moidectomie avec anastomose colo-rectale en janvier
1986. Le diagnostique anatomopathologique est un
adénocarcinome pT2N0. Compte tenu des antécédents
familiaux, ce patient est atteint d'un syndrome HNPCC
(critères modifiés d'Amsterdam).
La surveillance par coloscopie permet le diagnostic
d'une seconde localisation au niveau du colon droit en
1991 entraînant un geste chirurgical de colectomie
droite et curage lymphonodal. L'analyse anatomopa-
thologique diagnostique un adénocarcinome pT3N0.
En septembre 1993, une hématurie macroscopique fait
découvrir une tumeur urothéliale de l’uretère gauche à
l'urographie intraveineuse (Figure 1). La tomodensito-
métrie montre une tumeur urétérale sans invasion des
organes avoisinants (uro-scanner avec reconstruction
Manuscrit reçu : juin 2000, accepté : septembre 2000.
Adresse pour correspondance : Dr.A. de la Taille, Service d’Urologie, Hôpital
Claude Huriez, 1, place de Verdun, 59000 Lille.
e-mail : [email protected]
RESUME
Nous rapportons l'association chez un patient d'une tumeur urétérale et de carci-
nomes coliques dans le cadre du syndrome de prédisposition héréditaire aux cancers
coliques HNPCC (Hereditary Non Polyposis Colon Cancer).
Les critères de reconnaissance du syndrome HNPCC sont rappelés pour sensibiliser
les urologues à l'intérêt d'orienter l'interrogatoire de leurs patients porteurs de
tumeurs de la voie excrétrice supérieure vers les antécédents familiaux et vers la
sphère digestive.
Mots clés : Cancers colo-rectaux, héréditaires, uretère, tumeur urothéliale, syndrome de Lynch.

1205
Figure 2). Une néphro-urétérectomie est réalisée et
l'examen anatomopathologique permet le diagnostic de
carcinome urothélial de stade pTa et de grade 1. Le
suivi urologique consiste en un bilan biologique rénal
régulier, une urographie et une cystoscopie. En janvier
1997, une récidive d'une tumeur papillaire de très peti-
te taille (1 mm de diamètre) est vue au niveau du col
vésical. Une électrocoagulation sous anesthésie locale
est réalisée. Depuis cette date, le patient n’a pas pré-
senté d’autre localisation ou de récidive de sa maladie
urothéliale.
La surveillance de la pathologie colique met en évi-
dence en septembre 1998 une ascension progressive du
marqueurs CA19.9 (à 40.6 U/mL pour une normale
inférieure à 37 U/mL). Une coloscopie fait découvrir
une lésion suspecte à 42 cm de la marge anale. La biop-
sie diagnostique un adénocarcinome colique. Une
colectomie totale est réalisée en octobre 1998. Le
patient présentait à nouveau sur l'examen histologique
final une tumeur colique pT3N0. Le suivi ne retrouve
pas d’autre localisation ou de récidive. Une analyse
génétique a été réalisée: chez les patients d'une famille
du syndrome HNPCC ayant tous les critères
d'Amsterdam, seules les mutations sur les gènes de
réparation de l'ADN hMLH1 et hMSH2 sont recher-
chées. A.C. ne présentait pas de mutations de ces 2
gènes.
DISCUSSION
Le cancer du syndrome HNPCC est une maladie héré-
ditaire à transmission autosomique dominante suggé-
rant un conseil familial et un programme de dépistage
familial [3, 5]. La pénétrance de la maladie augmente
avec l’âge. Il existe 2 présentations du syndrome
HNPCC:
- soit le syndrome HNPCC est décrit comme étant l’as-
sociation de plusieurs cancers du colon au sein d’une
même famille à l’exclusion des autres cancers parmi
les apparentés. Ces cancers sont plus fréquemment
situés dans la partie droite du colon et surviennent pré-
cocement avant l’âge de 50 ans. Leur pronostic semble
meilleur que des cancers du même stade survenant
dans un cadre sporadique [7].
- soit le syndrome HNPCC (critères modifiés
d’Amsterdam) est l’association entre les cancers colo-
rectaux et des tumeurs hépatobiliaires, de l’endomètre,
de la voie excrétrice urinaire supérieure, de l’ovaire, de
l’estomac, ou du grêle. Les 6 critères de reconnaissance
de la conférence de consensus d'Amsterdam sont [14]:
- 3 parents atteints d’un cancer du colon, de l’endo-
mètre, de l’intestin, ou de la voie excrétrice;
- l’un des patients atteints doit être parent au premier
degré d’un des 2 autres;
- des cas doivent être présents sur 2 générations suc-
cessives;
- au moins un des patients doit être âgé de moins de 50
ans au moment du diagnostic;
A. de la Taille et coll., Progrès en Urologie (2000), 10, 1204-1207
Figure 1. Aspect de l’urographie intraveineuse d’une lésion du
tiers moyen de l’uretère gauche.
Figure 2. Uro-scanner avec reconstruction en 3 dimensions de
la tumeur urothéliale du tiers moyen de l’uretère gauche.

- la PolyAdénomatose Familiale doit être éliminée;
- les tumeurs doivent avoir un diagnostic histologique.
Quatre régions du génome sont actuellement identifiés
comme étant le siège de gènes responsables des prédis-
positions au cancer colorectal du syndrome HNPCC
[14]. Ils sont situés sur le chromosome 2 (3 locus), le 3
et le 7. Plusieurs gènes ont été impliqués (hMSH2,
hMLH1, hMSH6, PMS1 et PMS2) mais 2 sont particu-
lièrement fréquents: hMSH2 est retrouvé dans 31% des
patients HNPCC et hMLH1 dans 33% des cas. Ces
gènes sont impliqués dans la réparation des mésappa-
riements de l’ADN et leur altération conduit à une
instabilité du génome dans les cellules tumorales, par-
ticulièrement visible au niveau de locus de type micro-
satellites (séquences répétitives difficiles à retranscrire
et donc sources d'erreurs en cas d'anomalie des
enzymes de la réplication) [4, 8]. Il faut cependant sou-
ligner que 30% des patients présentant les critères
d’Amsterdam ne présentent pas d’anomalie au niveau
de ces gènes [14]. Peut être existe-t-il d'autres gènes
impliqués mais pas encore découverts. Dans notre labo-
ratoire, lorsqu'un patient présente tous les critères
d'Amsterdam, seules les mutations de hMLH1 et
hMSH2 sont recherchées. Il existe actuellement une
étude sur l'intérêt de la recherche systématique de
mutations de hMSH6 [2]. Concernant PMS1 et PMS2,
la littérature ne rapporte que trop peu de cas de muta-
tion dans le syndrome HNPCC répondant aux critères
d'Amsterdam pour que la recherche soit systématique
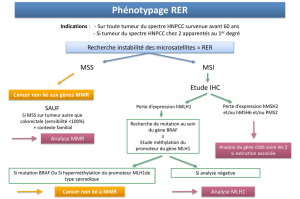
dans notre institution [2]. Le test RER (Replicative
Error), recherchant des anomalies au niveau des
séquences répétitives, n'est réalisé que si le patient ne
présente pas tous les critères d'Amsterdam dans notre
laboratoire.
Le risque cumulé de développer un cancer colo-rectal
et de l’endomètre chez les patients porteurs des gènes
mutés est estimée à 50% et 30% respectivement [11,
16]. Ce risque est aussi augmenté pour les cancers
hépato-biliaires, de l’estomac, du grêle, de l’uretère, du
bassinet, des ovaires et du cerveau [13, 14, 15]: les
études de Vasen [14] suggèrent que les porteurs de la
mutation hMSH2 ont un risque relatif accru de déve-
lopper un cancer des voies excrétrices supérieures
(Risque Relatif 75.3), de l’estomac (Risque Relatif
19.3) et des ovaires (Risque Relatif 7.57). Enfin
Sijmons et al [12] confirment l’augmentation de façon
significative du risque relatif des tumeurs urothéliales
de l’uretère et du bassinet (risque relatif 14.04 / risque
cumulé de 2,6%) mais pas du risque de tumeur vésica-
le ou rénale.
Pour l’urologue diagnostiquant ou ayant à traiter des
tumeurs urothéliales de la voie excrétrice supérieure, 2
études soulignent la fréquence d’une association avec
les tumeurs colo-rectales: BA
T
ATA rapporte 2 cas de
tumeurs coliques ou rectales sur 41 patients atteints
d’une tumeur de la voie excrétrice supérieurs [1].
KIRKAH montre que le suivi à 10 ans de patients atteints
d’une tumeur de l’uretère ou du bassinet, permet le
diagnostic d’une seconde tumeur extra-urinaire dans
11% des cas et que dans 75% de ces cas, il s’agit d’un
cancer colo-rectal [6]. Le risque d’avoir un cancer
colo-rectal pour un patient atteint d’une tumeur de la
voie excrétrice supérieure est multiplié par 4 [6]. Deux
études avaient proposé en 1989 [6] et en 1998 [12] des
études prospectives sur l'intérêt du dépistage des
lésions urothéliales chez les HNPCC ou du dépistage
des lésions coliques chez des patients atteints de
tumeur de la voie excrétrice. Aucune publication ne
rapporte de recommandation à ce jour.
CONCLUSION
Il n’existe pas actuellement de recommandation d’un
dépistage systématique du cancer colo-rectal des
patients suivi pour tumeur de la voie excrétrice supé-
rieure ni de dépistage systématique de tumeur urothé-
liale chez les patients (ou leur famille) atteints d’un
syndrome de HNPCC. Il est cependant licite de suggé-
rer, après analyse de la littérature, chez les patients pré-
sentant des antécédents familiaux de cancer entrant
dans le cadre du syndrome HNPCC (critères modifiés
d'Amsterdam), un interrogatoire orienté sur la sphère
digestive et qu’en cas d’anomalie, une coloscopie et/ou
un lavement baryté soient proposés.
REFERENCES
1. BATATA M.A., WHITMORE W.F., HILARIS B.S., TOKITA N.,
GRABSTALD H. Primary carcinoma of the ureter: a prognostic
study. Cancer, 1975, 35, 1626-1632.
2. BOLAND CR. Molecular genetics of hereditary nonpolyposis colo-
rectal cancer. Ann. N.Y. Acad. Sci., 2000, 910, 50-59.
3. BURKE W., DALY M., GARBER J., BOTKIN J., KAHN M.J.,
LYNCH P., MCTIERNAN A., OFFIT K., PERLMAN J.,
PETERSEN G., THOMSON E., VA R R I C C H I O C .
Recommendations for follow-up care of individuals with an inheri-
ted predisposition to cancer. II. BRCA1 and BRCA2. Cancer
Genetics Studies Consortium. J.A.M.A., 1997, 277, 997-1003.
4. FISHEL R., LESCOE M.K., RAO M.R., COPELAND N.G.,
JENKINS N.A., GARBER J., KANE M., KOLODNER R. The
human mutator gene homolog MSH2 and its association with here-
ditary nonpolyposis colon cancer. Cell, 1993, 75, 1027-1038.
5. JARVINEN H.J., MECKLIN J.P., SISTONEN P. Screening reduces
colorectal cancer rate in families with hereditary non polyposis colo-
rectal cancer. Gastroenterology, 1995, 108, 1405-1408.
6. KIRKALI Z., MOFFAT L.E., DEANE R.F., KYLE K.F., GRAHAM
A.G. Urothelial tumours of the upper urinary tract. Br. J. Urol.,
1989, 64, 18-24.
7. LAURENT-PUIG P. Le cancer colorectal hériditaire sans polypose
(HNPCC). Prise en Charge. Médecine & Chirurgie Digestives,
1998, 27, 8-9.
1206
A. de la Taille et coll., Progrès en Urologie (2000), 10, 1204-1207

____________________
8. LEACH F.S., NICOLAIDES N.C., PAPADOPOULOS N., LIU B.,
JEN J., PARSONS R., PELTOMAKI P., SISTONEN P. ,
AALTONEN L.A., NYSTROM-LAHTI M. Mutations of a mutS
homolog in hereditary nonpolyposis colorectal cancer. Cell, 1993,
75, 1215-1125.
9. LYNCH H.T., SMYRK T.C., WATSON P., LANSPA S.J., LYNCH
J.F., LYNCH P.M., CAVALIERI R.J., BOLAND C. Genetics, natu-
ral history, tumor spectrum and pathology of hereditary non polypo-
sis colo-rectal cancer: an updates review. Gastroenterology, 1993,
104, 1535-1549.
10. MAZEMAN E. Les tumeurs de la voie excrétrice urinaire supérieu-
re. J. Urol. (Paris), 1973, 2, 1-220.
11. MECKLIN J.P., SVENDSEN L.B., PELTOMAKI P., VASEN H.F.
Review: hereditary nonpolyposis colorectal cancer. Scand. J.
Gastroenterology, 1994, 29, 673-677.
12. SIJMONS R.H., KIEMENEY L.A., WITJES J.A., VASEN H.F.
Urinary tract cancer and hereditary nonpolyposis colorectal cancer:
risks and screening options. J. Urol., 1998, 160, 466-470.
13. VASEN H.F., SANDERS E.A., TAAL B.G., NAGENGAST F.M.,
GRIFFIOEN G., MENKO F.H., KLEIBEUKER J.H., HOUWING-
DUISTERMAAT J.J., MEERA KHAN P. The risk of brain tumours
in hereditary non-polyposis colorectal cancer (HNPCC). Int. J.
Cancer., 1996, 65, 422-425.
14. VASEN H.F., WIJNEN J.T., MENKO F.H., KLEIBEUKER J.H.,
TAAL B.G., GRIFFIOEN G., NAGENGAST F.M., MEIJERS-
HEIJBOER E.H., BERTARIO L., VARESCO L., BISGAARD M.L.,
MOHR J., FODDE R., KHAN P.M. Cancer risk in families with
hereditary nonpolyposis colorectal cancer diagnosed by mutation
analysis. Gastroenterology, 1996, 110, 1020-1027.
15. WATSON P., LYNCH H.T. Extracolonic cancer in hereditary non-
polyposis colorectal cancer. Cancer, 1993, 71, 677-685.
16. WATSON P., VASEN H.F., MECKLIN J.P., JARVINEN H.,
LYNCH H.T. The risk of endometrial cancer in hereditary nonpo-
lyposis colorectal cancer. Am. J. Med., 1994, 96, 516-520.
____________________
SUMMARY
Urothelial tumour and colonic cancer in the context of a
syndrome of hereditary predisposition to HNPCC colon
cancer.
The authors report the association of ureteric tumour and colon
c a rcinomas in the context of here d i t a ry predisposition to
HNPCC colon cancer (hereditary non polyposis colon cancer).
The recall the diagnostic criteria of HNPCC syndrome and
emphasize the importance of guiding the clinical interv i e w
of patients with upper urinary tract tumours in order to
detect a family history and the presence of gastro i n t e s t i n a l
t u m o u r s .
Key-Words: Colorectal cancers, hereditary, ureter, urothelial
tumour, Lynch syndrome.
1207
A. de la Taille et coll., Progrès en Urologie (2000), 10, 1204-1207
1
/
4
100%