D o s s i e r t h... tique Encadré

Dossier thématique
Dossier thématique
14
Encadré왘
La Lettre de l’Hépato-gastroentérologue - Vol. X - nos 1-2 - janvier-février 2007
Les critères de qualité en anatomie pathologique
pour la prise en charge d’un cancer colique
L. Antunes*
Le pathologiste doit formuler une réponse adaptée
aux modalités opératoires de la lésion qu’il est amené
à examiner. La mise en évidence d’un adénocarci-
nome infiltrant la sous-muqueuse développé sur
un polype réséqué endoscopiquement justi e une
résection chirurgicale complémentaire si la tumeur
comporte plus de 50 % de contingent peu di érencié
ou mucineux, s’il existe des emboles lymphatiques ou
veineux, si la marge d’exérèse est à moins de 1 mm
et si la tumeur in ltre le tiers le plus profond de la
sous-muqueuse (SM3) ou si elle atteint le milieu de
la sous-muqueuse (SM2) sur adénome sessile. Chacun
de ces items doit donc gurer dans le compte-rendu
du pathologiste.
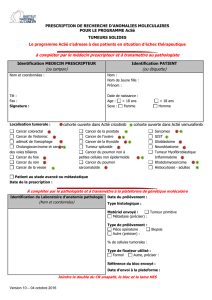
La prise en charge d’une pièce de colectomie carcinolo-
gique obéit à une démarche standardisée depuis 1998
avec la mise en place de référentiels indiquant quelles
informations doivent gurer dans le compte-rendu.
C’est d’ailleurs l’une des premières pathologies à avoir
béné cié d’une véritable approche pluridisciplinaire
ayant permis la mise en place d’une che standardisée
en anatomie pathologique. Une telle che facilite la
lecture par le clinicien, le gastroentérologue ou le
chirurgien, améliore la reproductibilité d’examen d’un
pathologiste à l’autre et permet d’éviter tout oubli
dans l’analyse. Le recul actuel valide l’utilisation d’un
tel document qui, s’il est informatisé, va permettre,
en outre, une extraction des données collectées à
visée épidémiologique. La che qui a été conçue en
1998 est toujours utilisable actuellement (lire docu-
ment ci-contre). Il convient toutefois d’apporter des
informations complémentaires si la tumeur est de
siège rectal en précisant la marge tumorale latérale,
l’épaisseur et la qualité d’exérèse du mésorectum.
Comme dans tout compte-rendu d’analyse d’une pièce
réséquée pour cancer, le pathologiste con rme (après
biopsie) ou a rme le diagnostic de malignité. Le reste
de l’examen consiste à évaluer l’extension de la maladie
(staging TNM), à rechercher des critères histopronos-
tiques indépendants et à réaliser, le cas échéant, des
techniques complémentaires, immunohistochimiques
ou par biologie moléculaire à visée diagnostique ou
thérapeutique selon le contexte clinique.
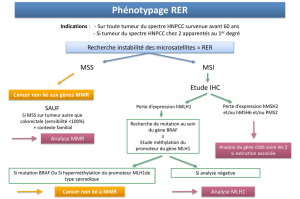
Dans le cadre du diagnostic, il convient de recher-
cher une mutation dans les gènes de prédisposition
aux cancers colorectaux chaque fois qu’un patient
répond à des critères retenus depuis 2001 par le réseau
national HNPCC (hereditary non polyposis colorectal
cancer) [tableau].
Le clinicien et le pathologiste doivent y penser chaque
fois qu’ils sont confrontés à un tel patient. Pour ce faire,
l’attitude la plus pragmatique consiste à demander
en même temps, à partir du même bloc d’inclusion
en para ne ayant permis le diagnostic d’adénocarci-
nome, une recherche d’instabilité des microsatellites
et une étude immunohistochimique de l’expression
des quatre protéines MMR (hMLH1, PMS2, hMSH2 et
hMSH6). La xation doit être formolée, l’utilisation
du liquide de Bouin étant proscrite depuis l’utilisation
courante de techniques d’immunohistochimie et de
biologie moléculaire. Ces deux examens sont rapides
(quelques jours) et peu coûteux (moins de 20 euros
par batterie complète). L’utilisation d’un pentaplex
constitué de cinq marqueurs mononucléotidiques
permet d’étudier l’instabilité de la tumeur sans
avoir à e ectuer une comparaison à celle de l’ADN
normal. L’immunohistochimie va con rmer l’ano-
malie et permettre d’identi er la ou les protéine(s)
anormale(s) et donc, conséquemment, le ou les
gène(s) incriminé(s). Il faut noter que des anoma-
lies non géniques, comme une hyperméthylation
anormale des gènes contrôlant la synthèse des
protéines MMR, peuvent être responsables d’une
instabilité mais, dans ce cas, le contexte clinique est
왘
généralement di érent, avec des patients nettement
plus âgés. Pour a rmer le diagnostic de mutation
HNPCC, il est possible, dans un deuxième temps,
de rechercher par génétique moléculaire, de façon
sélective, une mutation germinale du ou des gène(s)
ainsi sélectionné(s) à partir d’un prélèvement de sang
veineux. Cette investigation doit être particulièrement
ré échie, car longue (6 mois pour une recherche de
mutation germinale par DHPLC/séquençage chez un
cas index) et coûteuse (500 euros).
Dans le cadre de la thérapeutique, le pathologiste
peut être amené, à la demande de l’oncologue, à e ec-
tuer, parfois de manière di érée, une recherche sur
coupes dépara nées de l’expression par les cellules
tumorales de l’expression du récepteur de EGF dans
le traitement du cancer colorectal métastatique après
échec d’une chimiothérapie à base d’irinotécan a n de
permettre l’administration, si l’épitope est exprimé, d’un
anticorps monoclonal anti-EGFR1, le cétuximab. L’AMM
exige la mise en évidence sur coupe tissulaire de l’ex-
pression par les cellules tumorales du récepteur de EGF
en l’absence de seuil minimal d’expression. L’avènement
de nouvelles thérapies biologiques va ainsi davantage
impliquer le pathologiste dans la stratégie du choix
thérapeutique permettant de véritables traitements sur
mesure adaptés au pro l biologique de la tumeur.
En n, chaque fois que le pathologiste le pourra (tumo-
rothèque à disposition), un fragment de tumeur sera
congelé si les critères de qualité sont réunis (moins
de 1 h 30 entre l’ischémie de la tumeur et le condi-
tionnement nal du prélèvement). ■
왘
* Cabinet d'anatomie et de cytologie pathologiques, Thionville.
Tableau.
Critères de sélection de cas index pour une recherche de mutation HNPCC.
Bethesda : un critère Amsterdam I et II : tous les critères
• < 50 ans.
• Cancer colorectal ou du spectre HNPCC (intestin grêle,
endomètre, voies urinaires excrétrices) associé synchrone
ou métachrone.
• Instabilité microsatellite (MSI+) et histologie suggestive
(in ltrat lymphocytaire du stroma, di érenciation muci-
neuse ou bague à chaton, architecture médullaire) chez un
patient < 60 ans.
• Cancer colorectal diagnostiqué chez un parent de premier
degré atteint d’un cancer HNPCC avant 50 ans ou de deux
cancers HNPCC, quel que soit l’âge.
• < 50 ans.
• Deux générations atteintes.
• Trois parents atteints (un premier degré des
deux autres).
• PAF exclue.
• Certitude histologique d’adénocarcinome.

Dossier thématique
Dossier thématique
15
La Lettre de l’Hépato-gastroentérologue - Vol. X - nos 1-2 - janvier-février 2007
1
/
2
100%