Document

TERMINALE S – CHAPITRE 02
1/11
CHAPITRE 02 : SUIVI TEMPOREL D’UNE TRANSFORMATION
CHIMIQUE
I. DE QUOI ON PARLE
On a mis en évidence, qualitativement, le caractère « lent » ou « rapide » d’une
transformation chimique en regardant l’évolution d’une coloration. On va s’intéresser
dans ce chapitre à l’étude quantitative des quantités de matière au cours de la
transformation et aux paramètres qui influent sur la « vitesse » de la transformation.
Pour cela, il nous faut déterminer la quantité de matière de l’un des réactifs à chaque
instant (le tableau d’avancement nous permettant d’en déduire les autres).
On pourra alors représenter l’évolution des quantités de matière ou des concentrations
des espèces au cours du temps (cf TP) :
Afin de fixer les idées, nous travaillerons dans ce chapitre sur des exemples précis.
Les généralisations à d’autres systèmes chimiques sont immédiates.
II. DUREES CARACTERISTIQUES DE TRANSFORMATIONS
CHIMIQUES
Une transformation chimique est dite instantanée si sa durée caractéristique
d’évolution est inférieure à la seconde.
Exemples : toutes les transformations étudiées au collège et au lycée (en particulier
acido-basiques), mais aussi le déploiement d’un airbag, une explosion …
Une transformation est dite lente si sa durée caractéristique d’évolution est de l’ordre
de 10 secondes à 10 minutes. On peut alors étudier son évolution au laboratoire.
Exemples : Transformations vues aux TPs 1 et 2.
Une transformation est dite infiniment lente si sa durée caractéristique d’évolution
est de l’ordre de ou supérieure à 1h.
Exemples : Rouille, vieillissement du vin…
→ peut-on ralentir ou accélérer des transformations chimiques ?
t
ni ou [Xi]

TERMINALE S – CHAPITRE 02
2/11
III. FACTEURS CINETIQUES
On appelle facteur cinétique toute grandeur influençant la vitesse de la
transformation.
1. Influence de la concentration
Expérience :
25mL
()
3
HO Cl
+−
+et 25 mL d’une solution de thiosulfate de sodium
()
2
23
2Na S O
+−
+,
avec différentes concentrations en ions thiosulfate.
On voit que la teinte évolue plus rapidement dans le bécher contenant une solution
plus concentrée. De plus, la coloration finale est identique dans tous les béchers (tout
le réactif a réagi).
L’évolution est d’autant plus rapide que les concentrations en réactifs sont grandes.
(les concentrations en produits n’ont pas d’influence dans une transformation totale).
La concentration des réactifs est donc un facteur cinétique.
2. Influence de la température
Expérience : 25mL
()
3
HO Cl
+−
+et 25 mL
(
)
2
23
2Na S O
+
−
+ a trois températures
L’évolution est rapide à chaud, lente à température ambiante et infiniment lente dans
le bain de glace.
L’évolution est donc d’autant plus rapide que la température est élevée : la
température du milieu réactionnel est un facteur cinétique.
3. Applications
• Ralentir : congélation
• Accélérer : autocuiseur
• Trempe : diluer dans l’eau froide une solution dans laquelle se déroule une
transformation lente stoppe la transformation car la trempe ainsi réalisée agit sur
les deux facteurs cinétiques concentration des réactifs et température (nous avons
utilisé une trempe lors du TP1 afin de stopper la transformation chimique dans le
prélèvement et avoir le temps de doser le diiode.

TERMINALE S – CHAPITRE 02
3/11
IV. EVOLUTION TEMPORELLE D’UNE TRANSFORMATION
CHIMIQUE
1. Transformation étudiée
On utilisera comme exemple dans cette section la transformation lente entre les ions
iodure et les ions peroxodisulfates (étudiée au TP n°1), dont l’équation de réaction
est :
() () () ()
22
22
2
28 4
28 2 4
2 2
S 2 2S
2 aq S aq aq 2S aq
IIe
Oe O
IOIO
−−
−−
−
−
−
−
=
+
+=
+=+
Nous avons déterminé la quantité de diiode formée
(
)
2
I
nt à différentes dates en
dosant un prélèvement du mélange réactionnel par titrage.
2. Lien entre les titrages et l’avancement de réaction
Le tableau d’avancement de la transformation est le suivant :
()
(
)
(
)()
22
28 2 4
2 aq S aq aq 2S aqIOIO
−−−
+
=+
Etat initial
(t = 0)
()
10n
(
)
20n / /
Date t
()
(
)
102nxt−
(
)
(
)
20nxt
−
(
)
x
t
()
2
x
t
La quantité de matière de diiode formée à la date t s’identifie donc avec l’avancement
de réaction :
(
)
(
)
2
I
nt xt
=
(si vous avez des difficultés à lire un tableau d’évolution il est impératif de lire le
rappel à ce propos)
Connaissant les quantités de matière mises en contact à l’instant initial
(
)
10n et
()
20n, nous pouvons donc établir à partir des résultats du dosage
spectrophotométrique du diiode présent les quantités de matière des réactifs pour
toutes les dates t :
()
(
)
(
)
(
)
(
)
()
()
()
()
()
() () ()
2
2
22
4
11 1
22 2
2200
00
22
I
I
I
SO
x
x
x
nt n t n n t
nt n t n n t
nt tnt
−
−=−
−= −
=
=
==
On peut alors tracer le graphique de l’évolution des quantités de matière des espèces
chimiques dans le système en fonction du temps :

TERMINALE S – CHAPITRE 02
4/11
Si besoin, les concentrations à la date t se déduisent simplement des quantités de
matière en divisant par le volume total :
[]
()
[]
(
)
(
)
(
)()
2 2221
222
2
; ;
00
III
nt n nt n nt
IHO I
VV V
−
−−
== =
⎡⎤
⎣⎦
On remarque que l’évolution des quantités de matière est de moins en moins rapide
au cours du temps. Cela est bien compréhensible puisque nous savons que la
concentration des réactifs est un facteur cinétique et que, au fur et à mesure du
déroulement de la transformation, ces concentrations diminuent.
Afin de caractériser quantitativement la rapidité de la formation des produits au cours
de la transformation, nous allons définir deux nouvelles grandeurs.
V. VITESSE VOLUMIQUE DE REACTION
Nous chercherons ici à définir rigoureusement une notion de vitesse pour une
transformation chimique. Réfléchissons tout d’abord à la vitesse que nous
connaissons mieux : la vitesse d’un mobile en mécanique.
1. Petite digression mécanique
Soit un mobile M se déplaçant à vitesse constante sur un axe (Ox) ; soit x la distance
parcourue sur l’axe et t la durée qui s’est écoulée depuis le début du mouvement.
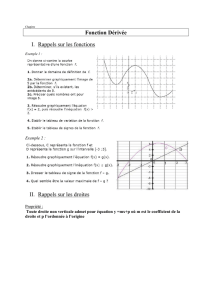
L’activation de quelques neurones suffit pour prévoir l’allure du graphe x = f(t) :
Evolution de la concentration en diiode
0
0,001
0,002
0,003
0,004
0,005
0,006
0 500 1000 1500 2000 2500 3000
t (s)
[I2] (mol/L)
Evolution des quantités de matière
0
0,0002
0,0004
0,0006
0,0008
0,001
0,0012
0 500 1000 1500 2000 2500 3000
t (s)
n (mol)
n(I2)
n(I-)
n(S2O82-)
n(SO42-)
t
x
A .

TERMINALE S – CHAPITRE 02
5/11
En effet la distance parcourue sur l’axe à vitesse constante est proportionnelle à la
durée du déplacement.
La vitesse du mobile est bien sûr :
x
vt
=
.
En particulier lorsque l’état du mobile est représenté par le point A du graphe :
A
AA
x
vt
=
Quelques secondes de réflexion permettent de comprendre que la vitesse du mobile
est donc le coefficient directeur de la droite x(t).
Considérons maintenant le graphe ci-dessous, représentant la distance parcourue sur
l’axe (Ox) par le mobile en fonction du temps lorsque sa vitesse n’est pas constante :
On a vu en 1eS que, pour évaluer la vitesse instantanée d’un mobile au point M, on
calculait la vitesse moyenne entre deux points proches I et J encadrant le point M.
Cette vitesse est la distance parcourue par le mobile entre les points I et J divisée par
la durée du parcours :
()
IJ J I
IJ J I
x
xx
vM ttt
−
==
−
Quelques secondes de réflexion permettent de comprendre que la vitesse du mobile
au point M est donc le coefficient directeur de la droite (IJ).
Pour obtenir une vitesse instantanée la plus précise possible, les points I et J doivent
être les plus proches possible du point M : la droite (IJ) correspondante est la tangente
à la courbe d(t). Rigoureusement, la vitesse instantanée au point M est donc le
coefficient directeur de la tangente à la courbe x(t).
2. Petite digression mathématique
Considérons l’évolution d’une grandeur physique quelconque X au cours du temps,
décrite par la fonction X(t). Soit son sa représentation graphique :
.
.
.
t
x
M
I
J
x
IJ
t
I
J
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%