Traitement du cancer de l`estomac métastatique : état des lieux et

474 | La Lettre du Cancérologue • Vol. XIX - n° 8 - octobre 2010
MISE AU POINT
Traitement du cancer
de l’estomac métastatique :
état des lieux et perspectives
en 2010
Treatment of metastatic gastric cancer:
state of the art and future perspectives in 2010
A. Lièvre*, G. Perkins**
* Service d’hépato-gastroentéro-
logie, hôpital Ambroise-Paré, Bou-
logne-Billancourt.
** Institute of Cancer Research, Sut-
ton, Royaume-Uni.
M
algré une diminution récente de son incidence
dans les pays développés occidentaux, le
cancer de l’estomac reste au quatrième rang
mondial des cancers, les deux tiers des cas survenant
en Asie, en Amérique du Sud et en Europe de l’Est. Il
représente également la deuxième cause de décès par
cancer. En France, plus de 6 700 cas sont diagnostiqués
chaque année, dont plus de 60 % à un stade métas-
tatique ou localement avancé, non accessible à une
résection chirurgicale. Par ailleurs, même en cas de
chirurgie à visée curative, plus de la moitié des patients
récidivent, ce qui explique le sombre pronostic de ce
cancer, dont le taux de survie à 5 ans, tous stades
confondus, est estimé à 25 % selon les récentes
données publiées par l’Institut national du cancer (1).
Ainsi, la grande majorité des patients ayant un cancer
gastrique vont relever d’un traitement palliatif au
cours de leur maladie, ce dernier reposant soit sur
l’administration d’une chimiothérapie lorsqu’elle est
possible, soit sur des soins de support en cas d’alté-
ration de l’état général ou de comorbidités. À l’heure
actuelle, plusieurs chimiothérapies conventionnelles
ainsi qu’une thérapie ciblée anti-HER2 ont montré
leur intérêt dans le traitement du cancer gastrique
métastatique. Cependant, aucun schéma de chimio-
thérapie standard en première ligne ne fait l’objet, à
l’heure actuelle, d’un consensus international. Par
ailleurs, l’intérêt d’une chimiothérapie de deuxième
ligne reste à démontrer. Cet article se propose de faire
le point sur les avancées thérapeutiques concernant
les chimiothérapies conventionnelles et les thérapies
ciblées ainsi que sur les perspectives d’avenir dans le
traitement du cancer gastrique métastatique.
Les chimiothérapies
“classiques” de référence
à l’aube du e siècle
Le traitement du cancer gastrique métastatique a
longtemps été limité à des soins de support. Depuis,
la chimiothérapie a montré, dans des essais rando-
misés de phase III et une méta-analyse, qu’elle
permettait d’améliorer la survie des patients
(HR : 0,39 ; IC
95
: 0,28-0,52 ; p < 0,00001) et de
diminuer les symptômes liés à la maladie par
rapport à des soins de support, tout en améliorant
la qualité de vie des patients (2-5). Historiquement,
la chimiothérapie ayant démontré ce bénéfice était
à base de 5 fluoro-uracile (5-FU) et d’une anthra-
cycline : protocoles ELF (étoposide, leucovorine,
5-FU), FAMTX (5-FU, doxorubicine, méthotrexate)
ou FEMTX (5-FU, épirubicine, méthotrexate). Par
ailleurs, la méta-analyse de 11 essais publiée par
A.D. Wagner et al. (5) a clairement montré qu’une
combinaison de plusieurs chimiothérapies donnait
de meilleurs résultats qu’une mono-chimiothérapie,
le plus souvent à base de 5-FU, en termes de taux
de réponse objective mais aussi de survie globale
(SG) [HR : 0,83 ; IC95 : 0,74-0,93 ; p = 0,001], au prix
cependant d’une plus grande toxicité obligeant à bien

La Lettre du Cancérologue • Vol. XIX - n° 8 - octobre 2010 | 475
Résumé
Si la chimiothérapie a montré sa supériorité en termes de survie par rapport à des soins de support chez les
patients ayant un cancer gastrique métastatique, son bénéfice restait particulièrement modeste jusqu’à une
période très récente où le traitement de référence était à base de 5-FU et de cisplatine associés ou non à
une anthracycline. Ces dernières années, de nouvelles combinaisons plus efficaces ou simplement plus faciles
d’emploi et mieux tolérées ont vu le jour, à base de docétaxel, irinotécan, oxaliplatine et/ou capécitabine, mais
aucun schéma standard ne fait l’objet, à l’heure actuelle, d’un consensus international. De plus, l’intérêt d’une
chimiothérapie de deuxième ligne reste à démontrer. Pour la première fois, une thérapie ciblée, le trastuzumab,
anticorps anti-HER2, a démontré son efficacité dans le traitement de ce cancer, mais elle ne concerne que les
20 % de tumeurs surexprimant HER2. Néanmoins, une meilleure connaissance des altérations moléculaires
caractérisant l’adénocarcinome gastrique a permis d’identifier de nouvelles cibles thérapeutiques, ce qui a
conduit à l’évaluation actuelle d’autres thérapies ciblées offrant de nouvelles perspectives de traitement.
Mots-clés
Cancer de l’estomac
Chimiothérapie
Thérapie ciblée
HER2
EpCAM
VEGF
EGFR
C-MET
Highlights
If chemotherapy has proved to
be superior to best supportive
care in patients with advanced
gastric cancer, its benefit
remained very limited until
recently, when reference
treatment was a combination
of 5-FU-cisplatin ± epirubicin.
Over the past few years, new
combinations, more efficient
or simply more convenient
or better tolerated, have
emerged, containing docetaxel,
irinotecan, oxaliplatin and/ or
capecitabine, but there is
currently no international
consensus on one standard
regimen. Moreover, the benefit
of a second-line chemotherapy
has not been demonstrated.
For the first time, a targeted
therapy, the anti-HER2 antibody
trastuzumab, has demonstrated
its effectiveness in the treat-
ment of this type of cancer,
but it only covers the 20% of
tumors overexpressing HER2.
Nevertheless, a better under-
standing of molecular altera-
tions that characterize gastric
adenocarcinoma has allowed
to identify new therapeutic
targets, leading to the current
evaluation of other targeted
therapies offering new perspec-
tives of treatment.
Keywords
Gastric cancer
Chemotherapy
Targeted therapy
HER2
EpCAM
VEGF
EGFR
C-MET
sélectionner les patients susceptibles de bénéficier
au mieux de ces associations. En démontrant sa
supériorité sur le protocole FAMTX, qui servait de
référence jusqu’alors (taux de réponse : 45 versus
21 % ; SG : 8,9 versus 5,7 mois), le protocole ECF
(épirubicine, cisplatine, 5-FU) est devenu un schéma
standard en Europe à la fin des années 1990, en dépit
de la contrainte liée à une perfusion continue de
5-FU (6). Compte tenu de l’absence de bénéfice
formellement démontré de l’ajout de l’épirubicine
à l’association 5-FU-cisplatine (CF), beaucoup
d’équipes ont préféré utiliser l’association CF
uniquement sous sa forme classique ou sous la forme
de LV5FU2-cisplatine (7, 8). Une méta-analyse de
7 essais a montré la supériorité d’une chimiothé-
rapie associant cisplatine, 5-FU et anthracycline sur
l’association 5-FU-anthracycline (5).
Ainsi, une chimiothérapie par ECF ou, plus
simplement, à base de CF a, jusqu’à récemment,
été considérée comme un schéma de référence
pour la pratique quotidienne et les essais cliniques
dans le traitement de première ligne du cancer
gastrique métastatique. Cependant, le bénéfice de
ce schéma, même s’il a été prouvé, n’en demeure
pas moins modeste en termes de survie et associé à
des réponses tumorales très faibles et relativement
courtes, et ce au prix d’une toxicité non négligeable
pour des patients dont l’état général est souvent
altéré du fait de la maladie tumorale elle-même,
mais aussi de sa localisation (primitif gastrique,
carcinose péritonéale), qui a des conséquences
nutritionnelles importantes. Cela a conduit à l’éva-
luation de nouveaux schémas de chimiothérapie
conventionnelle et de thérapie ciblée.
Chimiothérapies
conventionnelles “modernes”
Oxaliplatine
Alors que le cisplatine est associé à une toxicité à
la fois rénale, auditive et neurologique, qui vient
s’ajouter à des nausées et vomissements et à une
toxicité hématologique importante, l’oxaliplatine
est un sel de platine ayant un profil de toxicité
plus favorable, essentiellement caractérisé par une
toxicité sensitivo-motrice périphérique cumulative
et résolutive après l’arrêt du traitement. Après avoir
montré un effet antitumoral in vitro dans des lignées
cellulaires de cancer gastrique puis dans des études
de phase II, l’oxaliplatine a surtout fait la preuve
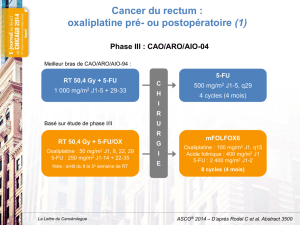
de son intérêt dans l’essai de phase III randomisé
REAL-2 (9). Dans cet essai de non-infériorité ayant
pour objectif d’évaluer respectivement l’oxali-
platine et la capécitabine comme alternatives au
cisplatine et au 5-FU, 1 002 patients ayant un cancer
œso-gastrique localement avancé ou métastatique
ont été randomisés pour recevoir le schéma de
référence ECF ou l’un des 3 schémas suivants : l’EOF
(épirubicine, oxaliplatine, 5-FU), l’ECX (épirubicine,
cisplatine, capécitabine) ou l’EOX (épirubicine, oxali-
platine, capécitabine) [tableau I, p. 476]. Le schéma
EOX donnait des taux de réponse et de SG équiva-
lents à ceux des 3 autres schémas ; en particulier, les
schémas à base d’oxaliplatine n’étaient pas inférieurs
aux schémas à base de cisplatine (tableau II, p. 477).
Au contraire, il y avait un bénéfice en survie signifi-
catif de l’EOX par rapport à l’ECF (HR : 0,80 ; IC95 :
0,66-0,97 ; p = 0,02). De plus, le profil de toxicité
était en faveur de l’oxaliplatine, associé à moins de
neutropénies et d’alopécies de grade 3-4, de toxicités
rénales et d’événements thrombo-emboliques, mais
à plus de diarrhées de grade 3-4 et de neuropathies.
Pour ces raisons, les auteurs ont conclu que l’oxali-
platine pouvait se substituer au cisplatine, de même
que la capécitabine au 5-FU, sans perte d’efficacité,
le schéma EOX étant plus pratique et mieux toléré
que l’ECF. Plusieurs études de phase II ont également
montré l’activité de l’association 5-FU-oxaliplatine
selon le protocole FOLFOX ou un protocole
similaire (10, 11). Dans une étude allemande de
phase III randomisée, FLO (5-FU, leucovorine, oxali-
platine) était moins toxique que l’association CF et
améliorait légèrement la survie sans progression
(SSP) [5,8 versus 3,9 mois ; p = 0,077]. Chez les
patients de plus de 65 ans (n = 94), le traitement
par FLO donnait des résultats supérieurs en termes
de réponse tumorale (41,3 versus 16,7 % ; p = 0,012),
de SSP (6,0 versus 3,1 mois ; p = 0,029) et de SG
(13,9 versus 7,2 mois) à ceux du schéma CF, et était
moins toxique (12).
Bien que n’ayant pas l’AMM, l’oxaliplatine en
première ligne du cancer gastrique métastatique est

476 | La Lettre du Cancérologue • Vol. XIX - n° 8 - octobre 2010
Traitement du cancer de l’estomac métastatique :
état des lieux et perspectives en 2010
MISE AU POINT
cependant proposé en remplacement du cisplatine
et en association avec l’épirubicine et la capécitabine
comme traitement de référence, ou sous la forme
du protocole FOLFOX, comme simple alternative
selon les recommandations du Thésaurus national
de cancérologie digestive (13).
Irinotécan
Dans la méta-analyse de A.D. Wagner et al. (5),
regroupant 2 études de phase II et 1 de phase III
pour un total de 536 patients, il y avait un petit
avantage en survie des schémas contenant de l’iri-
notécan par rapport aux schémas sans (essentiel-
lement CF), mais la différence n’était pas significative
(HR : 0,88 ; IC
95
: 0,73-1,06 ; p = 0,83) et ces schémas
n’ont jamais été comparés à une combinaison de
3 molécules. Dans l’unique étude de phase III rando-
misée comparant les associations 5-FU-irinotécan
(IF) et CF, le schéma IF n’était cependant pas signi-
ficativement supérieur au CF, mais il présentait
un meilleur profil de toxicité (tableau II) [14],
ce qui était également le cas dans l’essai de phase II
randomisé de la FFCD 9803 (FOLFIRI versus LV5FU2-
cisplatine versus LV5FU2), où le FOLFIRI était mieux
toléré que le LV5FU2-cisplatine et semblait offrir de
meilleurs résultats en termes de taux de réponse,
de SSP et de SG (15).
L’irinotécan n’a cependant pas obtenu l’AMM dans
cette indication, mais le schéma FOLFIRI peut être
proposé comme une alternative dans certains cas,
après discussion en réunion de concertation pluri-
disciplinaire (RCP), d’après les recommandations du
Thésaurus national de cancérologie digestive (13).
Docétaxel
Le docétaxel a montré une certaine efficacité dans
le cancer gastrique en monothérapie ou associé
à d’autres molécules telles que le cisplatine. Afin
d’évaluer si l’ajout du docétaxel à un traitement de
référence à base de 5-FU et cisplatine (DCF) pouvait
améliorer la survie des patients par rapport au CF
seul, une étude multicentrique internationale de
Tableau I. Principaux triplets de chimiothérapies “modernes” avec ou sans thérapies ciblées utilisés dans le traitement du
cancer gastrique métastatique.
Protocole Schéma Durée des cycles
ECF Épirubicine 50 mg/m2 à J1
Cisplatine 60 mg/m2 à J1
5-FU 200 mg/m2/j continu J1-J21
J1 = J22
21 jours
ECX Épirubicine 50 mg/m2 à J1
Cisplatine 60 mg/m2 à J1
Capécitabine 525 mg/m2 × 2/j J1-J21
J1 = J22
21 jours
EOF Épirubicine 50 mg/m2 à J1
Oxaliplatine 130 mg/m2 à J1
5-FU 200 mg/m2/j continu J1-J21
J1 = J22
21 jours
EOX Épirubicine 50 mg/m2 bolus à J1
Oxaliplatine 130 mg/m2 à J1
Capécitabine 625 mg/m2 × 2/j J1-J21
J1 = J22
21 jours
DCF Docétaxel 75 mg/ m2 à J1
Cisplatine 75 mg/m2 à J1
5-FU 750 mg/m2/j J1-J5
J1 = J22
21 jours
Trastuzumab 8 mg/kg en dose de charge à C1 puis 6 mg/kg à partir de C2 à J1
Cisplatine 80 mg/m2 à J1
5-FU 800 mg/m2/j J1-J5
J1 = J22
21 jours
Trastuzumab 8 mg/kg en dose de charge à C1 puis 6 mg/kg à partir de C2 à J1
Cisplatine 80 mg/m2 à J1
Capécitabine 1000 mg/m2 × 2/j J1-J15
J1 = J22
21 jours
C1 : 1er cycle de chimiothérapie ; C2 : 2e cycle de chimiothérapie.

La Lettre du Cancérologue • Vol. XIX - n° 8 - octobre 2010 | 477
MISE AU POINT
Tableau II. Résultats des études randomisées de phase II et III ayant évalué des polychimiothérapies “modernes” et/ou des thérapies ciblées dans le cancer
gastrique métastatique.
Molécule
principale
Référence Schémas Nombre
de patients
Taux
de réponse (%)
Survie sans progression
médiane (mois)
Survie globale
médiane (mois)
Oxaliplatine D. Cunningham
et al.
(9)
ECF
ECX
EOF
EOX
1 002 40,7
46,4
42,4
47,9
6,2
6,7
6,5
7,0
9,9
9,9
9,3
11,2* (p = 0,02)
S.E. Al-Batran
et al.
(12)
FLP
FLO
220 27,0
34* (p = 0,012)
3,9
5,8
8,8
10,7
Irinotécan M. Dank
et al.
(14)
CF
IF
333 25,8
31,8
4,2
5,0
8,7
9,0
O. Bouché
et al.
(15)
LV5FU2
LV5FU2/C
FOLFIRI
136 13,0
27,0
40,0
3,2
4,9
6,9
6,8
9,5
11,3
Docétaxel E. Van Cutsem
et al.
(16)
CF
DCF
445 25,0
37* (p = 0,01)
3,7
5,6* (p < 0,001)
8,6
9,2* (p = 0,02)
A.D. Roth
et al.
(19)
DC
DCF
ECF
119 18,5
36,6
25,0
4,4
5,4
7,8
11,0
10,4
8,3
P.C. Thuss-Patience
et al.
(20)
DF
ECF
90 37,8
35,6
5,5
5,3
9,5
9,7
Capécitabine D. Cunningham
et al.
(9)
ECF
ECX
EOF
EOX
1 002 40,7
46,4
42,4
47,9
6,2
6,7
6,5
7,0
9,9
9,9
9,3
11,2* (p = 0,02)
Y.K. Kang
et al.
(21)
CF
CX
316 32,0
46,0* (p = 0,02)
5,0
5,6* (p < 0,001)
9,3
10,5* (p = 0,008)
J. Yun
et al.
(23)
CX
ECX
91 38,0
37,0
6,4
6,5
S-1 W. Koizumi
et al.
(24)
S-1
S-1/C
305 31,0
54,0
4,0
6,0* (p < 0,0001)
11,0
13,0* (p = 0,04)
N. Boku
et al.
(25)
5-FU
Iri/C
S-1
704 9,0
38,0
28,0
2,9
4,8* (p < 0,0001)
4,2* (p = 0,0027)
10,3
12,3
11,4* (p = 0,0005)
J.A. Ajani
et al.
(26)
5-FU/C
S-1/C
1 053 31,9
29,1
5,5
4,8
7,9
8,6
Trastuzumab E. Van Cutsem
et al.
(32)
5-FU ou Cap/C
5-FU ou Cap/C/TZ
594 34,5
47,3* (p=0,0017)
5,5
6,7* (p = 0,0002)
11,1
13,8* (p = 0,0048)
Bévacizumab Y.K. Kang
et al.
(51)
5-FU ou Cap/C
5-FU ou Cap/C/Bév
774 37,0
46* (p = 0,0315)
5,3
6,7* (p = 0,0037)
10,1
12,1
Bév: bévacizumab ; C : cisplatine ; Cap: capécitabine ; Iri : irinotécan ; TZ: trastuzumab.
* Différence statistiquement significative (p < 0,05) par rapport au schéma de référence souligné (pour les études de phase III uniquement).

478 | La Lettre du Cancérologue • Vol. XIX - n° 8 - octobre 2010
Traitement du cancer de l’estomac métastatique :
état des lieux et perspectives en 2010
MISE AU POINT
phase III randomisée (étude V325) a été réalisée
chez 445 patients non prétraités (16). Ses résultats
étaient en faveur du bras DCF concernant le taux de
réponse, la SSP (HR : 1,47 ; IC
95
: 1,19-1,82 ; p = 0,001)
et la SG (HR : 1,29 ; IC
95
: 1,00-1,60 ; p = 0,02)
[tableau II], au prix d’une toxicité hématologique
plus importante. Cependant, malgré cette toxicité,
le DCF améliorait la qualité de vie des patients
et était associé à un bénéfice clinique dans cette
étude (17, 18), qui a permis au docétaxel d’obtenir
l’AMM, en association avec le cisplatine et le 5-FU,
en première ligne de traitement du cancer gastrique
métastatique.
Une étude de phase II randomisée a également
comparé 2 schémas à base de docétaxel-cisplatine
avec ou sans 5-FU (DC et DCF) au traitement de
référence par ECF (19). Les meilleurs résultats étaient
obtenus avec le bras DCF pour ce qui concernait le
taux de réponse, objectif principal de cette étude
(36 % pour le DCF versus 25 % pour l’ECF et 19 %
pour le DC) et la SSP (7,8 mois versus 5,5 mois
et 4,4 mois respectivement) [tableau II]. Enfin,
l’association docétaxel-5-FU en perfusion continue
semblait comparable à l’ECF dans une autre étude
de phase II randomisée (20).
Afin de réduire la toxicité importante du schéma
DCF classique, et notamment la toxicité hémato-
logique (82 % de neutropénie de grade 3-4 et
30 % de neutropénie fébrile dans l’étude V325), il
est désormais recommandé d’y associer du G-CSF
(granulocyte colony-stimulating factor), mais des
schémas de DCF modifié (avec des doses moins
importantes de docétaxel, de cisplatine et de
5-FU sur 48 h par exemple) sont d’ores et déjà à
l’étude afin d’améliorer le profil de toxicité de cette
association tout en maintenant son efficacité.
Fluoropyrimidines orales
L’essai de phase III randomisé REAL-2 (9), détaillé
précédemment, a montré que la capécitabine
était aussi efficace en termes de survie que le
5-FU en traitement de première ligne du cancer
œso-gastrique localement avancé ou métasta-
tique (HR : 0,86 ; IC95 : 0,80-0,99). Les schémas
à base de capécitabine (EOX et ECX) n’étaient,
en effet, pas inférieurs aux schémas à base de
5-FU (EOF et ECF) [tableau II]. Une étude rando-
misée asiatique et sud-américaine de phase III,
dont l’objectif principal était de démontrer la
non-infériorité en SSP d’une association cisplatine-
capécitabine (CX) [cisplatine 80 mg/ m2 à J1, capéci-
tabine 1 000 mg/m
2
× 2/j de J1 à J14 par cycle de
21 jours] par rapport à l’association CF chez des
patients traités en première ligne, a montré avec le
schéma CX un taux de réponse objective de 46 %,
une SSP médiane de 5,6 mois et une SG médiane
de 10,5 mois (21). Ces chiffres étaient supérieurs à
ceux obtenus avec le schéma CF et confirment la
non-infériorité de la capécitabine par rapport au
5-FU, en association avec le cisplatine (HR : 0,81 ;
IC
95
: 0,63-1,04 ; p < 0,001). Le profil de toxicité du
CX était également similaire à celui du CF, hormis
pour le syndrome mains-pieds, plus fréquent avec
le CX (22 versus 4 %). Dans une méta-analyse
de cette étude et de l’essai REAL-2, la chimio-
thérapie contenant la capécitabine donnait des
taux de réponse objective et de SG supérieurs à
ceux obtenus avec la chimiothérapie contenant
le 5-FU (22).
Les anthracyclines ayant démontré leur intérêt
en association avec le CF dans la méta-analyse de
A.D. Wagner et al. (5), une récente étude rando-
misée de phase II a évalué les schémas CX et ECX et
rapporté des résultats similaires avec ces 2 schémas
(tableau II) [23], ce qui suggère que le schéma CX
pourrait être une alternative raisonnable à l’ECX
en termes d’efficacité et de tolérance (12 % des
patients du bras ECX ont interrompu leur traitement
en raison d’une toxicité versus 0 % des patients du
bras CX).
L’autre fluoropyrimidine orale évaluée dans le
cancer gastrique est le composé S-1, prodrogue
du 5-FU associée à un inhibiteur de sa principale
enzyme catabo lique. Ce composé, disponible
uniquement en Asie et surtout évalué au Japon,
a montré son intérêt dans le cancer de l’estomac
dans plusieurs essais randomisés japonais de
phase III. L’essai SPIRITS a montré que l’asso-
ciation S-1-cisplatine était supérieure au S-1 seul
et permettait d’offrir un taux de réponse de 54 % et
une SG médiane de 13 mois, jamais observée dans
cette situation (tableau II) [24]. Une autre étude
japonaise de phase III menée chez 704 patients
ayant un cancer gastrique non résécable a rapporté,
pour son critère principal qui était la SG, l’absence
de supériorité de l’association irinotécan-cisplatine
(médiane : 12,3 mois ; HR = 0,85 ; IC95 : 0,70-1,04 ;
p = 0,055), et la non-infériorité du S-1 (médiane :
11,4 mois ; HR : 0,83 ; IC
95
: 0,68-1,01 ; p = 0,0005)
comparé au 5-FU en monothérapie (médiane :
10,8 mois) [25]. Le profil de toxicité était celui
attendu avec chacune de ces molécules, c’est-à-
dire une toxicité similaire pour le 5-FU et le S-1,
hormis la diarrhée, plus importante avec le S-1,
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%