Traitement des maladies inflammatoires chroniques de l`intestin et

CURRICULUM Forum Med Suisse No46 13 novembre 2002 1091
Le traitement des patients souffrant maladies
inflammatoires chroniques de l’intestin (MICI)
est encore et toujours un grand défi pour l’in-
terniste et le gastroentérologue, en raison de
l’importante variabilité de l’évolution de ces
maladies. Au cours de ces dernières années, de
nouveaux traitements ont été introduits et les
indications aux traitements actuels ont changé.
Lors du congrès annuel de la Société suisse de
Gastroentérologie et Hépatologie (SSGH) à
Interlaken, il a été tenté de donner une sorte
d’aperçu – de «state of the art» – de l’état
actuel des connaissances sur le traitement des
MICI, sur la base de quatre situations pratiques.
En référence à la présentation qui a été faite,
l’article ci-dessous traite du traitement diffé-
rentiel de la poussée aiguë, de l’entretien de la
rémission, et de la symptomatologie sténo-
sante de la maladie de Crohn. Un article sub-
séquent discutera du traitement de la colite
ulcéreuse, des fistules de la maladie de Crohn
et des manifestations extra-intestinales des
MICI.
Traitement de la poussée
du Crohn et d’entretien
de la rémission
Cas 1
Une étudiante de 26 ans se présente avec
une anamnèse de diarrhées depuis 2 mois,
de crampes abdominales récidivantes, d’une
perte de poids de 5 kg et d’une température
de 38,1 °C. Cette patiente fume environ 20
cigarettes par semaine. Elle ne prend pas
d’anti-inflammatoires non stéroïdiens. Sa
sœur de 30 ans souffre d’une maladie de
Crohn iléo-caecale. A l’examen physique, il
n’y a qu’une discrète douleur à la pression
du quadrant inférieur droit de l’abdomen.
Le laboratoire montre un MCV à 78, un
hématocrite à 33% et une VS augmentée à
45 mm/h. La colonoscopie révèle des éro-
sions aphteuses au niveau de l’iléon et des
hémorroïdes internes. L’histologie donne
comme résultat une iléite granulomateuse,
la muqueuse colique étant normale. Le tran-
sit sélectif du grêle montre une atteinte des
20 derniers cm de l’iléon, compatible avec
une maladie de Crohn non sténosante.
Quelles sont les options
thérapeutiques chez cette patiente?
Nous avons le choix entre mésalazine, anti-
biotiques, budésonide et prednisone.
Cette patiente est convaincue par le médecin
qu’elle doit cesser de fumer. Un traitement
est mis en route par mésalazine 4 g. Son état
général s’améliore peu après, mais sa diar-
rhée s’aggrave. La mésalazine est interrom-
pue et un traitement de ciprofloxacine est
instauré à raison de 2 500 mg par jour.
Une semaine plus tard, la patiente se sent
nettement mieux. Elle n’a plus de douleur et
la consistance de ses selles se normalise.
Après 3 mois de traitement, elle est totale-
ment asymptomatique, et le traitement de
ciprofloxacine est poursuivi à raison de 1
500 mg par jour.
Comment poursuivre le traitement
à ce stade?
Aucun autre traitement, poursuite du traite-
ment par mésalazine, ciprofloxacine (dose?),
traitement d’entretien par 6-mercaptopu-
rine ou azathioprine?
Cette patiente poursuit un traitement d’en-
tretien par ciprofloxacine 500 mg par jour.
Après 6 mois, elle présente une nouvelle
poussée avec douleurs, diarrhée et tempé-
ratures subfébriles. La toxine de Clostridium
difficile est négative, raison pour laquelle la
ciprofloxacine est augmentée à 2 500 mg
par jour, mais les symptômes ne s’atténuent
pas.
Quel traitement proposez-vous
à ce stade?
Antibiotique supplémentaire, ou différent?
Stéroïdes? Infliximab? Azathioprine? 6-mer-
captopurine? Méthotrexate?
Cette patiente reçoit alors 40 mg de predni-
sone et 50 mg d’azathioprine chaque jour.
Traitement des maladies inflamma-
toires chroniques de l’intestin
et de leurs complications (1ère partie)
P. Michetti, C. M. Oneta, F. Seibold
Correspondance:
PD Dr. med. Frank Seibold
Gastroenterologische Abteilung
Inselspital
CH-3010 Bern

CURRICULUM Forum Med Suisse No46 13 novembre 2002 1092
Elle s’améliore nettement en l’espace de 48
heures. Après une semaine, la prednisone
peut être abaissée de 5 mg chaque semaine
et l’azathioprine augmentée à 100 mg par
jour (2 mg/kg de poids corporel). Cette amé-
lioration ne dure que 3 semaines. La patiente
présente soudain de violentes douleurs épi-
gastriques, avec des vomissements à répéti-
tion. Le laboratoire montre une augmenta-
tion de l’amylase à 800 u/l, à la suite de quoi
l’azathioprine est interrompue. Et la pa-
tiente récupère à nouveau cliniquement en
l’espace de 48 heures. Mais après diminu-
tion des stéroïdes à 10 mg par jour, elle pré-
sente à nouveau des crampes et des diar-
rhées.
Quelles sont alors les options
thérapeutiques
Augmentation de la dose de prednisone?
Infliximab? Méthotrexate?
La prednisone est augmentée à 20 mg/jour,
ce qui améliore très nettement la sympto-
matologie de la patiente. Elle reçoit une per-
fusion de 250 mg d’infliximab, ensuite de
quoi la prednisone peut être progressive-
ment diminuée. Un traitement de métho-
trexate est abandonné car cette patiente veut
un enfant. Trois mois après la perfusion d’in-
fliximab, elle présente une nouvelle poussée,
bien contrôlée par une seconde perfusion
d’infliximab. L’évolution est ensuite sans
complications sous traitement probiotique.
Traitement de la maladie
de Crohn en phase aiguë
Nous savons maintenant que l’évolution de la
maladie est influencée par des facteurs envi-
ronnementaux, dont notamment la fumée [1].
L’arrêt de la consommation de nicotine diminue
de moitié le risque de poussée et permet de ré-
duire significativement la prednisone ou l’im-
munosuppresseur.
Le traitement de prednisone est toujours le
standard du traitement de la poussée du Crohn.
Plusieurs études multicentriques ont pu dé-
montrer l’effet bénéfique de la prednisone dans
le Crohn en phase aiguë, mais environ 50% de
ces maladies intestinales inflammatoires de-
viennent réfractaires aux stéroïdes au cours de
la première année de traitement, ou les patients
deviennent cortico-dépendants [2].
Le budésonide est une alternative possible pour
le traitement de la maladie de Crohn active, et
s’utilise essentiellement dans l’atteinte iléo-
caecale. Bien que les études n’aient fait ressor-
tir aucune différence significative entre predni-
sone et budésonide, certains experts sont
d’avis, en fonction de leur expérience clinique,
que le budésonide est moins efficace que la
prednisone, surtout dans les évolutions graves
de cette maladie [3].
Les antibiotiques ont une place dans le traite-
ment de la maladie de Crohn active, c’est cer-
tain. Plusieurs études ont montré qu’une mono-
thérapie par ciprofloxacine est équivalente à
un traitement de prednisone [4]. Par contre,
une monothérapie par métronidazole est moins
efficace, mais peut parfaitement être utilisée en
association à la ciprofloxacine [5].
Une méta-analyse a montré que l’azathioprine
ou la 6-mercaptopurine agissent chez une
grande partie des patients souffrant d’un Crohn
et ayant une cortico-résistance ou cortico-
dépendance, même s’il faut généralement
attendre 2 ou 3 mois pour que ces substances
déploient leur effet [6].
L’anticorps anti-TNF-alpha, l’infliximab, est
maintenant une bonne alternative chez les pa-
tients réfractaires aux stéroïdes ou aux immu-
nosuppresseurs. L’expérience clinique courante
concorde fort heureusement avec les résultats
des études en vue de son admission [7].
Nous pouvons résumer en disant que pour un
traitement adéquat d’une maladie de Crohn en
phase aiguë, il faut tenir compte de son activité
du moment et de son évolution.
Traitement d’entretien chez
les patients souffrant
d’une maladie de Crohn
Le pilier du traitement d’entretien, et ceci sur-
tout pour une maladie de Crohn cortico-réfrac-
taire ou cortico-dépendante, est l’azathioprine
ou la 6-mercaptopurine [8]. La dose usuelle
d’azathioprine est de 2–2,5 mg/kg de poids
corporel, et celle de 6-mercaptopurine de
1,5 mg/kg de poids corporel. En cas d’intolé-
rance à l’azathioprine, le méthotrexate peut
être utilisé comme alternative. L’injection sous-
cutanée ou intramusculaire de 15 mg de mé-
thotrexate est efficace pour maintenir la rémis-
sion. Le méthotrexate peut également s’admi-
nistrer à raison de 7,5–25 mg par semaine par
voie orale (mais pas chez les patients ayant soit
une atteinte iléale, soit subi une résection iléale)
[9]. Dans les rares situations où un traitement
d’entretien par azathioprine, 6-mercaptopurine
ou méthotrexate n’est pas possible, il est pos-
sible de donner l’infliximab. Mais il faut savoir
que l’expérience à long terme est encore très
insuffisante. Et des études montrent qu’une
grande partie des patients ayant reçu réguliè-
rement de l’infliximab n’y répond plus après
une année [10].
Quelques petites études ont attribué un certain
rôle dans le traitement d’entretien de la mala-
die de Crohn à des probiotiques, souches non

CURRICULUM Forum Med Suisse No46 13 novembre 2002 1093
pathogènes d’E. coli (Nissle, 1917) ou Saccha-
romyces boulardi [11].
La mésalazine n’a pratiquement aucune place
dans le traitement d’entretien d’une rémission
induite par les médicaments [12]. Et son inté-
rêt thérapeutique dans la maladie de Crohn
postopératoire semble limité [13]. Mais certains
experts attribuent à la mésalazine un certain
bénéfice chez un sous-groupe de patients, sur
la base de leurs expériences cliniques.
Les patients traités par placebo ou budésonide
ne se différencient plus de manière significative
après un an en matière de réponse au traite-
ment, c’est pour cette raison que le budésonide
n’a aucune place dans le traitement à long terme
de la maladie de Crohn [14]. Les stéroïdes sys-
témiques n’ont aucune place ici non plus.
Traitement de la
symptomatologie sténosante
de la maladie de Crohn
Cas 2
Un homme de 42 ans se présente au service
des urgences avec des douleurs abdomi-
nales, des crampes, des nausées et vomisse-
ments à répétition. Cette symptomatologie
s’est installée depuis environ 12 heures. Ce
patient a une maladie de Crohn connue de-
puis plusieurs années. 4 ans auparavant, il
a subi une résection de 25 cm de l’iléon en
raison d’une sténose. A part une diarrhée
chologène traitée par cholestyramine, ce pa-
tient va assez bien depuis lors. Il reçoit ré-
gulièrement de la vitamine B12. A l’admis-
sion, il présente un abdomen ballonné avec
des bruits intestinaux intenses, une douleur
à la pression et une défense modérées dans
la fosse iliaque droite. Il est afébrile. L’abdo-
men à vide montre des anses grêles dilatées
avec niveaux hydroaériques, et la TC montre
un iléon distal épaissi. Il n’y a pas d’abcès.
Quelles sont les options
thérapeutiques en cas de symptomato-
logie sténosante?
Opération; jeûne et expectative; stéroïdes,
infliximab; dilatation endoscopique?
Une sonde gastrique est tout d’abord mise en
place, pour administrer à ce patient beau-
coup de liquides. Il reçoit également des li-
quides par voie intraveineuse, et une corti-
cothérapie est mise en route par cette même
voie. Il ne répond pas à ce traitement après
2 jours, pas plus cliniquement que radiolo-
giquement, et il est donc opéré. Pour résé-
quer son importante sténose au niveau de
son iléon néoterminal, il faut lui enlever de
nouveau 30 cm d’iléon.
Comment prévenir les récidives post-
opératoires de la maladie de Crohn?
Aucun traitement, les récidives ne pouvant
être prévenues; 5-ASA; stéroïdes; métroni-
dazole, azathioprine; méthotrexate?
Après discussion approfondie avec le pa-
tient, et à sa demande, une prophylaxie de
récidive est mise en route par azathioprine
(2,5 mg/kg de poids corporel), qu’il tolère
bien. Le patient est asymptomatique depuis
plus de 2 ans.
Sténoses de la maladie de Crohn
Les sténoses se forment généralement sur des
lésions inflammatoires aiguës d’une part, et de
l’autre sur des lésions fibrosées. Ces dernières
ne réagissent pas aux médicaments. L’inflam-
mation aiguë, par contre, qui s’accompagne
d’un œdème de la paroi, répond classiquement
bien aux corticostéroïdes. Les sténoses princi-
palement inflammatoires peuvent souvent très
bien se diagnostiquer aux ultrasons (épaissis-
sement des parois dans les secteurs atteints). Il
y a en principe plusieurs possibilités de traiter
une symptomatologie sténosante. A part le
jeûne et la mise au repos du tractus gastro-
intestinal, p.ex. par sonde gastrique (voir
exemple), les options thérapeutiques sont mé-
dicamenteuses, endoscopiques et chirurgi-
cales.
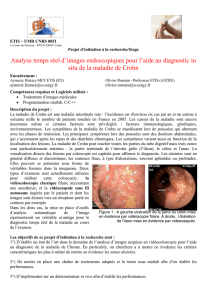
Dilatation au ballonnet
des sténoses du Crohn
Les dilatations au ballonnet sont indiquées pour
les sténoses principalement fibrosées, alors que
les sténoses principalement inflammatoires ne
profitent pas d’une telle intervention à long
terme. Comme les sténoses du Crohn sont sou-
vent en partie fibrosées et en partie inflamma-
toires, il faut donner un traitement anti-inflam-
matoire efficace en complément à la dilatation
au ballonnet. La littérature ne comporte pas de
grandes études sur la dilatation au ballonnet
par voie endoscopique. La proportion d’amé-
lioration clinique manifeste oscille entre 62% et
78%. D’après la littérature et notre expérience
personnelle, les résultats obtenus sont pour la
plupart limités dans le temps. Le succès de ce
traitement peut toutefois être maintenu par
dilatations successives. L’incidence des com-
plications atteint 11% [15–17]. La dilatation
n’est pas possible chez une partie des patients,
pour des raisons techniques ou si la sténose est
trop étendue.

CURRICULUM Forum Med Suisse No46 13 novembre 2002 1094
Traitement médicamenteux
des sténoses inflammatoires
Les stéroïdes restent toujours le traitement de
choix. Ils entraînent la plupart du temps une
décongestion rapide de la muqueuse enflam-
mée et améliorent très nettement la sympto-
matologie clinique. Certains groupes de travail
leur associent des antibiotiques. Mais aucune
étude clinique n’a été effectuée sur cette ma-
nière de faire. En cas de symptomatologie sté-
nosante récidivante, il faut envisager soit une
intervention chirurgicale, soit un traitement
immunosuppresseur à long terme par azathio-
prine (à une dose de 2,5 mg/kg de poids cor-
porel) ou 6-mercaptopurine (à une dose de 1–5
mg/kg de poids corporel) (voir ci-dessus). Ces
médicaments permettent de diminuer durable-
ment l’activité de la maladie chez une majorité
des patients, ce qui permet même d’éviter une
opération à certains. Mais avant de commencer
un tel traitement, il faut naturellement discuter
le potentiel des effets indésirables avec le pa-
tient. Les plus importants sont leucopénie,
hépatite, pancréatite, alopécie et nausée. Les
contrôles réguliers des examens de laboratoire
et un traitement progressif permettent de re-
connaître rapidement les effets indésirables
sérieux, et de les prévenir à temps. En cas d’in-
tolérance à l’azathioprine, il est possible de
donner du méthotrexate (15 mg/semaine en
sous-cutané) en alternative. En plus de sa téra-
togénicité, ce dernier se caractérise par un pro-
fil d’effets indésirables semblable à celui de
l’azathioprine, avec, pour un faible pourcen-
tage de patients, une pneumonie pouvant lais-
ser des séquelles pulmonaires irréversibles,
sous forme de fibrose pulmonaire.
Opération des sténoses
Les sténoses ne répondant pas au traitement
pharmacologique, inabordables par l’endosco-
pie pour une dilatation au ballonnet ou occa-
sionnant au patient des douleurs chroniques,
doivent être opérées par résection du segment
grêle atteint ou par stricturoplastie. Les
conglomérats tumoraux notamment, ou les sté-
noses avec fistules, ne doivent pas d’emblée
être traités par dilatation au ballonnet par voie
endoscopique ni par traitement médicamen-
teux seul, et le patient doit passer par une opé-
ration. Après résection, la qualité de vie de la
plupart des patients s’améliore très nettement,
vu que leurs douleurs ont disparu. Mais l’in-
convénient est la diarrhée chologène, surtout
après résection iléale, qui peut toutefois être
traitée par cholestyramine.
Prophylaxie des récidives
postopératoires?
Il est bien connu que 40% des patients Crohn
présenteront une nouvelle poussée symptoma-
tique au cours des 2 premières années post-
opératoires [18]. Nous savons également que
la probabilité d’une intervention chirurgicale
augmente fortement avec la durée du Crohn.
Après 5 ans, par exemple, elle est d’environ
30%, et de 55% déjà après 10 ans [19]. Pour
cette raison, plusieurs études se sont intéres-
sées à la question de savoir comment prévenir
les récidives postopératoires. Une méta-ana-
lyse montre que la mésalazine (5-ASA) a un
effet bénéfique sur la prévention des poussées
postopératoires chez un tel collectif de patients
Crohn [12]. Mais ceci n’a pas été confirmé dans
une nouvelle étude, dans laquelle les patients
ont été traités par 4 g de 5-ASA en postopéra-
toire immédiat [13]. 23% des patients traités
par 5-ASA contre 32% de ceux traités par pla-
cebo ont présenté une poussée, cette différence
étant statistiquement non significative. L’ana-
lyse des sous-groupes montre cependant un
bénéfice significatif de ce traitement chez les
patients ayant une atteinte isolée du grêle. Le
bénéfice clinique d’un traitement de 5-ASA
comme entretien des rémissions à la phase
postopératoire doit donc être considéré comme
relativement limité.
La corticothérapie est sans aucun doute un trai-
tement très efficace et largement utilisé dans
l’induction d’une rémission de poussée aiguë.
Plusieurs études confirment cependant nette-
ment que le traitement chronique par stéroïdes
systémiques ou budésonide n’est pas significa-
tivement meilleur que le placebo [14]. Nous
devons admettre que la 6-mercaptopurine ou
l’azathioprine ont un effet favorable sur l’en-
tretien d’une rémission, même chez un patient
Crohn opéré. Mais nous n’avons pour l’heure
aucune bonne donnée prospective. Des études
sont en cours qui devraient préciser les choses.
Aucune étude prospective n’a de même été en-
treprise sur l’indication du méthotrexate en
postopératoire. Les antibiotiques et le métroni-
dazole ont également été utilisés dans de petites
études en prophylaxie postopératoire des réci-
dives. A une dose de 20 mg/kg de poids corpo-
rel/jour, 7% seulement des patients traités par
métronidazole ont présenté une poussée après
une année, contre 25% de ceux traités par pla-
cebo. Après 2 ans de suivi, ces proportions ont
été de 29% contre 43%, également en faveur du
métronidazole. Mais le nombre de ces patients
est trop petit pour qu’il s’en dégage une signi-
fication statistique [19].

CURRICULUM Forum Med Suisse No46 13 novembre 2002 1095
1 Forbes A. Smoking and inflamma-
tory bowel disease. Eur J Gastroen-
terol Hepatol 1996;8:761–3.
2 Munkholm P, Langholz E, Davidsen
M, Binder V. Frequency of gluco-
corticoid resistance and depen-
dency in Crohn’s disease. Gut 1994;
35:360–2.
3 Rutgeerts P, Lofberg R, Malchow H,
Lamers C, Olaison G, Jewell D, et al.
A comparison of budesonide with
prednisolone for active Crohn’s
disease. N Engl J Med 1994;331:
842–5.
4 Prantera C, Zannoni F, Scribano
ML, Berto E, Andreoli A, Kohn A,
Luzi C. An antibiotic regimen for the
treatment of active Crohn’s disease:
a randomized, controlled clinical
trial of metronidazole plus cipro-
floxacin. Am J Gastroenterol 1996;
91:328–32.
5 Sutherland L, Singleton J, Sessions
J, Hanauer S, Krawitt E, Rankin G,
et al. Double blind, placebo con-
trolled trial of metronidazole in
Crohn’s disease. Gut 1991;32:
1071–5.
6 Pearson DC, May GR, Fick GH,
Sutherland LR. Azathioprine and 6-
mercaptopurine in Crohn’s disease.
A meta-analysis. Ann Intern Med
1995;123:132–42.
7 Targan SR, Hanauer SB, van De-
venter SJ, Mayer L, Present DH,
Braakman T, et al. A short-term
study of chimeric monoclonal anti-
body cA2 to tumor necrosis factor
alpha for Crohn’s disease. Crohn’s
Disease cA2 Study Group. N Engl J
Med 1997;337:1029–35.
8 Sandborn WJ. Rational dosing of
azathioprine and 6-mercaptopu-
rine. Gut 2001;48:591–2.
9 Feagan BG, Rochon J, Fedorak RN,
Irvine EJ, Wild G, Sutherland L, et
al. Methotrexate for the treatment
of Crohn’s disease. The North
American Crohn’s Study Group In-
vestigators. N Engl J Med 1995;
332:292–7.
10 Hanauer S. Maintenance infliximab
for Crohn’s disease: the Accent I
randomised trial. Lancet 2002;359:
1541.
11 Guslandi M, Mezzi G, Sorghi M,
Testoni PA. Saccharomyce boulardii
in maintenance treatment of Crohn’s
disease. Dig Dis Sci 2000;45:1462–
4.
12 Camma C, Giunta M, Rosselli M,
Cottone M. Mesalamine in the
maintenance treatment of Crohn’s
disease: a metaanalysis adjusted
for confounding variables. Gas-
troenterology 1997;113:1465–73.
13 Lochs H, Mayer M, Fleig WE,
Mortensen PB, Bauer P, Genser D,
et al. Prophylaxis of postoperative
relapse in Crohn’s disease with
mesalamine: European Cooperative
Crohn’s Disease Study VI. Gas-
troenterology 2000;118:264–73.
14 Greenberg GR, Feagan BG, Martin
F, Sutherland LR, Thomson AB,
Williams CN, et al. Oral budesonide
as maintenance treatment for
Crohn’s disease: a placebo-con-
trolled, dose-ranging study. Cana-
dian Inflammatory Bowel Disease
Study Group. Gastroenterology
1996;110:45–51.
15 Dear KL, Hunter JO. Colonoscopic
hydrostatic balloon dilatation of
Crohn’s strictures. J Clin Gastroen-
terol 2001;33:315–8.
16 Couckuyt H, Gevers AM, Coremans
G, Hiele M, Rutgeerts P. Efficacy and
safety of hydrostatic balloon dilata-
tion of ileocolonic Crohn’s stric-
tures: a prospective long-term
analysis. Gut 1995;36:577–80.
17 Breysem Y, Janssens JF, Coremans
G, Vantrappen G, Hendricks G, Rut-
geerts P. Endoscopic balloon dila-
tation of colonic and ileo-colonic
Crohn’s strictures: long-term re-
sults. Gastrointest Endosc 1992;38:
142–7.
18 McLeod RS, Wolff BG, Steinhart AH,
Carryer PW, O’Rourke K, Andrews
DF, et al. LH. Risk and significance
of endoscopic/radiological evidence
of recurrent Crohn’s disease. Gas-
troenterology 1997;113:1823–7.
19 Rutgeerts P, Hiele M, Geboes K,
Peeters M, Penninch F, Aerts R,
Kerremans R. Controlled trial of
metronidazole treatment for pre-
vention of Crohn’s recurrence after
ileal resection. Gastroenterology
1995;108:1617–21.
Quintessence
Le traitement de la poussée de la maladie de Crohn reste fondamentale-
ment le même (stéroïdes, antibiotiques). L’infliximab est un complément
nouveau au traitement d’une poussée grave et réfractaire au traitement
classique.
L’azathioprine, la 6-mercaptopurine ou le méthotrexate doivent être
utilisés pour l’entretien d’une rémission de la maladie de Crohn. Il faut
cesser la consommation de nicotine.
Dans la prise en charge postopératoire de la maladie de Crohn, il est
recommandé d’effectuer une colonoscopie de contrôle après 6 mois, si
l’évolution est favorable. Un traitement médicamenteux par azathioprine
ou 6-mercaptopurine n’est indiqué que si l’activité de la maladie est élevée.
Mais il faut envisager d’administrer ces immunosuppresseurs sans tarder
après chirurgie à répétition ou en cas d’évolution agressive.
Références
1
/
5
100%