Ae 17 synthese chimique - Enseignement des Sciences Physiques

Seconde_Thème 2_LA SANTE
AE 17_Synthèse d’une espèce chimique
M.Meyniel 1/2
SYNTHESE D’UN ESTER ODORANT AU LABORATOIRE
Objectif : - Mettre en œuvre un protocole expérimental pour réaliser la synthèse d’une molécule et son identification.
Mme Sick lit sur une boîte de médicaments pour enfants que l’arôme de la pastille a été fabriqué dans un
laboratoire. En se renseignant, elle découvre que la réaction de la synthèse de cet arôme est la suivante :
Document 1 : La réaction de synthèse
L’acétate de 3-méthylbutyle (ou acétate d’isoamyle) est un ester utilisé dans l’alimentaire pour son odeur et
sa saveur. Nous allons la fabriquer à l’aide de la réaction chimique suivante :
C5H12O + C2H3O2 C9H8O + H2O
3-méthylbutan-1-ol acide acétique acétate d’isoamyle eau
On se propose ici de synthétiser à notre tour l’arôme.
I. La synthèse de l’ester.
Document 2 : Protocole expérimental de synthèse
Dans le ballon, introduire 20 mL de 3-méthylbutan-1-ol puis 30 mL d’acide acétique pur (dit « glacial »)
à l’aide de la même éprouvette. L’acide acétique est introduit en excès.
Ajouter avec précaution ( !!! ) une vingtaine de gouttes d’acide sulfurique concentré.
Placer quelques grains de pierre ponce dans le milieu réactionnel.
Placer le réfrigérant à boules sur le ballon et allumer la circulation d’eau du réfrigérant.
Placer le chauffe-ballon à l’aide du boy et porter le mélange à ébullition pendant environ 20 minutes.
Arrêter le reflux et baisser le chauffe-ballon.
Laisser alors refroidir le mélange réactionnel toujours avec le réfrigérant d’abord à l’air libre puis
ensuite à l’aide d’un cristallisoir contenant de l’eau froide.
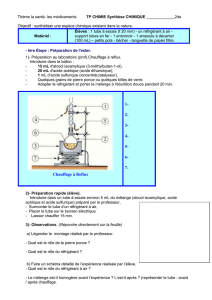
1. Annoter en indiquant aussi le sens de l’eau et titrer le schéma du montage expérimental.
2. Quel est le rôle du réfrigérant droit ? Pourquoi ce montage est-il appelé chauffage à reflux ?
3. Quels sont les rôles du chauffage, de l’acide sulfurique et de la pierre ponce ?
4. Pourquoi le réfrigérant doit-il rester ouvert à son extrémité supérieure ?
H2SO4
acide sulfurique

Seconde_Thème 2_LA SANTE
AE 17_Synthèse d’une espèce chimique
M.Meyniel 2/2
II. Extraction de l’ester.
Document 3 : Propriétés physiques des espèces chimiques
Document 4 : Protocole expérimental d’extraction
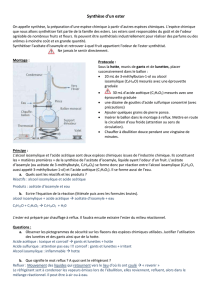
Retirer le réfrigérant à boules.
Verser le mélange dans une ampoule à décanter à l’aide d’un entonnoir et d’un papier filtre de façon à
pouvoir retenir les grains de pierre ponce.
Ajouter dans l’ampoule à décanter 100 mL d’une solution de chlorure de sodium (Na+,Cl-) à l’aide d’une
éprouvette graduée.
Agiter puis laisser décanter.
Eliminer la phase aqueuse.
Laver la phase organique en versant dans l’ampoule de 50 mL une solution saturée
d’hydrogénocarbonate de sodium, solution basique, à l’aide d’une éprouvette graduée.
Laisser l’effervescence se produire puis agiter à nouveau et laisser décanter.
Eliminer la phase aqueuse et récupérer la phase organique dans un erlenmeyer.
Sécher la phase organique en ajoutant du chlorure de calcium jusqu’à pulvérulence (le solide reste alors
sous forme de poudre, il ne s’agglomère plus) après agitation. Récupérer la phase organique dans le pot de yaourt
en utilisant un entonnoir et un papier filtre pour éliminer le solide.
1. Compléter le schéma ci-dessus de la première extraction.
2. Pourquoi utilise-t-on de l’eau contenant du chlorure de sodium ?
3. Quelle espèce chimique essaie-t-on principalement d’éliminer au cours du lavage ? Justifier.
4. Quel est le rôle du séchage ?
3-méthylbutan-1-ol
acide acétique
acétate d’isoamyle
Densité
0,81
1,03
0,87
Température d’ébullition (sous patm)
130 °
118 °
142 °
Solubilité dans l’eau
Assez faible
Très soluble
Assez faible
Solubilité dans l’eau salée
Quasi nulle
Très soluble
Quasi nulle

Seconde_Thème 2_LA SANTE
AE 17_Synthèse d’une espèce chimique
M.Meyniel 3/2
Matériel :
Par binôme :
- 1 ballon de 250 mL
- 1 réfrigérant à boules
- 1 chauffe-ballon
- 1 boy
- 1 potence + pince + noix
- 20 mL de 3-méthylbutan-1-ol
- 30 mL d’acide acétique pur
- flacons d’acide sulfurique concentré
- 1 éprouvette de 100 mL
- quelques grains de pierre ponce
- cristallisoir
- gants + lunette
- entonnoir
- papier filtre * 2
- ampoule à décanter
- 100 mL d’une solution de chlorure de sodium saturée
- 1 bécher de 250 mL
- 50 mL d’une solution d’hydrogénocarbonate de sodium saturée
- 1 erlenmeyer de 100 mL
- spatule + chlorure de calcium anhydre
- 1 pot de yaourt
1
/
3
100%