Synthèse d'acétate d'isoamyle : Exercice de chimie

SYNTHESE D'UNE ESPECE CHIMIQUE
Objectifs : Réaliser la synthèse d'une espèce chimique, l'acétate d’isoamyle (
appartenant à la famille des esters ), employée en parfumerie et comme arôme
alimentaire.
La réaction qui permet cette synthèse est :
Acide acétique
+
Alcool isoamylique
Acétate d’isoamyle
+
eau
Utiliser les techniques du chauffage à reflux et de séparation.
Respecter les consignes de sécurité.
1. LE CHAUFFAGE A REFLUX.
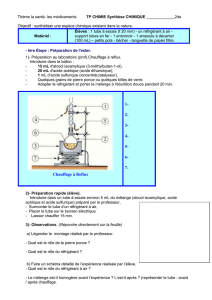
1.1. Protocole expérimental.
Se munir des gants et des lunettes pour manipuler tous
les produits.
Introduire avec précaution dans un ballon de 250 mL,
successivement : 10 mL d’alcool isoamylique et 15 mL
d'acide acétique .
Introduire ensuite dans le ballon, à l'aide d'une pipette et
d'une propipette, 1 mL d'acide sulfurique concentré.
Ajouter dans le mélange quelques grains de pierre ponce et
installer sur le ballon le réfrigérant à eau vertical.
Mettre en route la circulation d'eau froide.
Porter le mélange à ébullition douce (40 %) pendant
environ 30 minutes.
1.2. Exploitation.
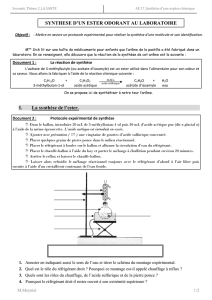
1) Légender le schéma du montage en utilisant les termes suivants
Support élévateur, réfrigérant à eau, eau froide, eau tiède, pierre ponce, mélange
réactionnel, ballon, chauffe ballon.
2) Justifier les consignes de sécurité prises lors des prélèvements des réactifs.
3) Pourquoi le mélange est-il chauffé ? Quel peut-être le rôle des grains de pierre
ponce ?
4) Expliquer le rôle du réfrigérant et indiquer ce qu'il se passerait en son absence.
5) Pourquoi le réfrigérant doit-il rester ouvert à son extrémité supérieure ?
6) Sachant qu’on a mis de l’acide acétique en excès par rapport à l’alcool, qu’y a-t-il
dans le ballon à la fin ?
2. SEPARATION DE L’ESTER
2.1. Protocole expérimental.
Arrêter le chauffage, abaisser le chauffe-ballon, puis laisser refroidir 5 minutes à l'air.
Utiliser un gant pour retirer le ballon et le plonger dans l’eau froide.

Introduire, à l'aide d'une éprouvette graduée, environ 50 mL d'une solution concentrée
de chlorure de sodium (eau salée) par petites quantités.
Agiter doucement, puis transvaser le tout avec un entonnoir muni d’une grille dans une
ampoule à décanter tout en retenant les pierres ponces.
Agiter l’ampoule et laisser décanter.
2.2. Exploitation.
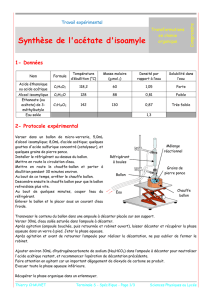
1) A l'aide du tableau ci-dessous, expliquer le rôle de l'eau salée.
Espèce
chimique
densité
Température
d'ébullition
(°C)
Solubilité dans
l'eau salée
Acide acétique
1,05
118
très grande
Alcool
isoamylique
0,81
130
faible
Acétate
d’isoamyle
0,87
142
très faible
Faire un schéma de l'ampoule à décanter après l'agitation en indiquant la phase
aqueuse et la phase organique. Préciser sur le schéma la composition des deux phases.
3. LAVAGE DE L’ESTER
Eliminer la phase inférieure dans un bécher. Que reste-t-il dans l’ampoule à décanter ?
On veut neutraliser l’acide acétique restant. Pour cela, verser 25 mL environ d’une
solution d’hydrogénocarbonate de sodium (ne pas remettre le bouchon de l’ampoule,
car un important dégagement de dioxyde de carbone se produit ).
Evacuer toute la phase aqueuse inférieure.
Que reste-t-il dans l’ampoule ?
4. SECHAGE DE L’ESTER
Ajouter une petite spatulée de sulfate de magnésium anhydre. Quel est son rôle ?
Boucher et agiter pendant quelques minutes.
Que reste-t-il dans l’ampoule ?
A quel parfum naturel, le produit de cette synthèse vous fait-il penser ?
1
/
2
100%