Synthèse d`esters odorants

TS TP : Synthèse d’esters odorants
Préliminaire : la réaction d’un acide carboxylique avec un alcool forme un ester et de l’eau. Cette
réaction est très lente et limitée.
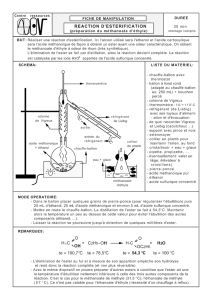
1. Montage de distillation fractionnée (doc2p262) : synthèse d’un ester à odeur de rhum : le
méthanoate d’éthyle.
a) Matériel : support élévateur , chauffe-ballon, ballon, colonne de Vigreux, thermomètre,
réfrigérant à eau (réfrigérant de Liebig), éprouvette graduée, balance.
b) Réaction : déterminer les noms des réactifs dans la nomenclature systématique, leur formule
chimique et écrire l’équation de la transformation chimique.
c) Caractéristiques physiques :
Espèces chimiques
Acide
Alcool
Ester
µ (g.cm-3)
1,22
0,79
0,91
téb (°C)
100,7
78,5
54,3
Solubilité dans l’eau
Très grande
Faible
Très faible
NB : la température de l’ester formé est très inférieure à celle des réactifs.
d) Protocole expérimental :
Peser l’éprouvette graduée.
Introduire avec précaution dans le ballon : 23,5 mL d’acide à 85%, 34 mL d’alcool à 90°, puis
environ 20 gouttes d’acide sulfurique concentré (catalyseur) ; ajouter quelques grains de pierre
ponce pour réguler l’ébullition.
Chauffer (thermostat 6) pendant 15 à 20 minutes en contrôlant la température en haut de la
colonne de Vigreux. Arrêter le chauffage quand elle dépasse 60°C. Dans la colonne, observer la
liquéfaction des vapeurs sur les pointes.
Peser l’éprouvette contenant le liquide et mesurer le volume de liquide de liquide obtenu.
e) Questions :
1. Schématiser et légender le montage.
2. Calculer les quantités de matière des réactifs ; conclure.
3. Pourquoi chauffe-t-on le mélange réactionnel ?
4. A quoi sert le boy (support élévateur) ?
5. Quel est le rôle des grains de pierre ponce ?
6. Quel est le rôle de l’acide sulfurique ?

7. Identifier le liquide recueilli dans l’éprouvette à la sortie du réfrigérant à eau. Déterminer sa
masse, puis sa masse volumique. Comparer aux données.
8. Calculer la quantité d’ester obtenue, puis le rendement de l’opération.
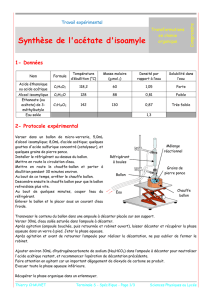
2. Montage de chauffage à reflux (doc1p262) : synthèse d’un ester à odeur de banane :
l’éthanoate de 3-méthylbutyle.
a) Matériel : support élévateur , chauffe-ballon, ballon,, réfrigérant à eau vertical (réfrigérant à
boules).
b) Réaction : déterminer les noms des réactifs dans la nomenclature systématique, leur formule
chimique et écrire l’équation de la transformation chimique.
c) Caractéristiques physiques :
Espèces chimiques
Acide
Alcool
Ester
µ (g.cm-3)
1,05
0,81
0,87
téb (°C)
118
128,5
142
Solubilité dans l’eau
Très grande
Faible
Très faible
d) Protocole expérimental :
Introduire avec précaution dans le ballon : 20 mL d’alcool pur, 35 mL d’acide à 85%, puis environ
20 gouttes d’acide sulfurique concentré (catalyseur) ; ajouter quelques grains de pierre ponce pour
réguler l’ébullition.
Chauffer (thermostat 6) pendant 15 à 20 minutes. Dans les boules du réfrigérant, observer la
liquéfaction des vapeurs (reflux).
e) Questions :
1. Schématiser et légender le montage.
2. Calculer les quantités de matière des réactifs ; conclure.
3. Pourquoi chauffe-t-on le mélange réactionnel ?
4. A quoi sert le boy (support élévateur) ?
5. Quel est le rôle des grains de pierre ponce ?
6. Quel est le rôle de l’acide sulfurique ?
7. Pourquoi chauffer à reflux ?
f) Remarques : L’ester se trouve dans le ballon, mélangé à d’autres espèces. Pour l’extraire de ce
milieu réactionnel, il faudrait procéder à un refroidissement et un lavage à l’eau salée, puis à une
décantation, suivie d’un nouveau lavage à l’hydrogénocarbonate de sodium de la phase organique
pour éliminer l’acide éthanoïque restant. Une dernière décantation permettrait d’isoler l’ester.
1
/
2
100%