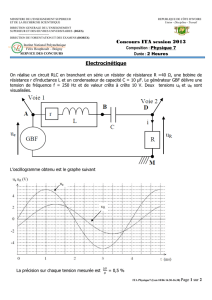
TD n°5 - Description des systèmes fermés de composition constante

1/3
TD Physique n°5 : Description des systèmes fermés à composition constante
* Exercice 1 : Transformations d’un gaz parfait
I. On considère 0,500 mole de diazote, contenu dans un cylindre vertical fermé par un piston glissant sans frottement dans le
cylindre. Les parois du cylindre sont de bons conducteurs thermiques.
On place un objet de masse m constante sur le piston et on attend l’équilibre. L’azote est alors dans l’état initial (1) caractérisé par
la pression P1 = 1,5 bar et la température
10,0C
. On plonge ensuite le cylindre dans un thermostat à la température constante
2100,0C
. Le piston se déplace lentement jusqu’à ce que son niveau se stabilise : la pression qu’il exerce sur le gaz est supposée
constante au cours de la transformation. On indique que le diazote est un gaz parfait de rapport
1,4
.
1. Caractériser la nature de la transformation subie par le diazote.
2. Exprimer puis calculer la variation d’enthalpie du diazote. En déduire la quantité de chaleur Q reçue par le diazote.
3. Calculer le travail W reçu par le diazote.
II. On considère 0,200 mole d’helium, contenu dans une enceinte dont la température est constante et égale à 10,0°C, ce qui
constitue un thermostat. Dans l’état initial, l’helium est à la pression P1 = 10,0 bar et à la température du thermostat. On réalise
une détente très progressive du gaz jusqu’à la pression finale P2 = 1,0 bar, l’équilibre thermique étant toujours réalisé avec le
thermostat. On indique que l’helium est considéré comme un gaz parfait (
1,4
)
1. Caractériser la nature de la transformation. Dans un diagramme (P,V) (V en abscisse et P en ordonnée), tracer la courbe
représentant cette transformation.
2. Exprimer puis calculer le travail reçu par le gaz au cours de la transformation.
3. Déterminer la variation d’énergie interne et de l’enthalpie au cours de la transformation.
4. Donner alors la quantité de chaleur reçue par le gaz au cours de la transformation.
** Exercice 2 : Cycle de Stirling
Un cycle de Stirling est formé de deux isothermes (T1 < T2) et de deux isochores (V1 < V2) alternées.
Le cycle est supposé réversible ; il est décrit dans le sens moteur par n moles de gaz parfait caractérisé
par le coefficient supposé constant.
1. En fonction des températures T1 et T2, du taux de compression
aV2
V1
et de n, R et
, établir
les expressions des quantités de chaleur reçu par le fluide au cours de chacune des étapes.
2. En déduire la quantité de chaleur reçue par le système au cours d’un cycle moteur réversible (notée Q2) et la quantité de
chaleur cédée par le système au cours d’un cycle moteur réversible (notée Q1).
3. Le rendement de ce moteur se calcule suivant la formule :
. Justifier cette formule et exprimer .
** Exercice 3 : Détente d’un gaz parfait
Un récipient contient initialement n = 0,100 mol de diazote, considéré comme un gaz parfait, à la pression P1 = 2,00 bar et à la
température . Il est relié par un tube à un cylindre horizontal, fermé par un piston de masse négligeable. Le piston peut
glisser sans frottement, et la pression extérieure Pe est constante égale à 1,00 bar. Initialement, le cylindre est vide et le robinet du
tube de liaison est fermé. Les parois et le piston sont des isolants thermiques parfaits. On ouvre le robinet. Le piston se déplace
lentement jusqu’à ce que le diazote soit à l’équilibre dans l’état final (2). Donnée :
= 1,40 pour le diazote.
1. Quelle est la pression finale P2 du diazote ?
2. Exprimer le travail des forces pressantes de deux manières différentes.
3. En déduire l’expression puis la valeur de la température finale T2 du diazote.
4. Calculer la variation d’entropie du diazote.

2/3
** Exercice 4 : Evolution d’un système à deux enceintes
Soit un cylindre indéformable constitué de deux enceintes séparées par une paroi mobile sans
frottement, le mouvement de la paroi s’effectuant horizontalement. Les parois du cylindre et de la paroi
mobile sont supposées athermanes.
Initialement chacune des deux enceintes renferme un même volume d’helium sous une
pression et à une température .
On considère que l’hélium est un gaz parfait (
). On chauffe l’enceinte (E1) par une résistance chauffante R et on suppose que
la transformation est très lente. On note (E2) l’autre enceinte.
On arrête le chauffage lorsque la pression de l’enceinte (E1) vaut .
1. Déterminer les valeurs de la pression , de la température et du volume , dans l’enceinte (E2) à l’état final.
2. Déterminer les valeurs de la température et du volume , dans l’enceinte (E1) à l’état final.
3. Calculer les variations d’énergie interne de l’hélium dans chacune des deux enceintes.
4. En déduire le travail électrique fourni par la résistance chauffante.
** Exercice 5 : Compression d’un gaz parfait
On considère un cylindre aux parois athermanes, fermé par un piston également athermane de masse négligeable, mobile sans
frottement, contenant un gaz considéré comme parfait de rapport = Cp,m/Cv,m constant. A l’équilibre le piston se trouve à la distance
h1 du fond du cylindre.
1. On pose sur le piston une masse M0. Le piston descend brutalement et s’immobilise à une distance h2 du fond du récipient.
a. Calculer le travail W échangé avec le milieu extérieur, ainsi que l’état final (P2, T2, V2) du gaz.
b. Calculer la variation d’entropie de l’air contenu dans le cylindre.
Données : P0 = 105 Pa ; g
10 m.s-2 ; S = 0,1 m2 ; M0 = 100 kg ; h1 = 1m ; T1 = 300 K ;
= 1,4.
2. En repartant de l’état initial, on pose successivement sur le piston des masses m très petites (m<< M0) en attendant chaque fois
que le piston se stabilise avant de poser la masse suivante. On arrête dès que la masse totale des surcharges atteint la valeur
M0.
a. Calculer le travail W’ échangé avec le milieu extérieur, ainsi que le nouvel état final (P’2, T’2, V’2) du gaz.
b. Calculer la variation d’entropie de l’air contenu dans le cylindre.
état final
état initial
h1
P0
P1, T1, V1
h2
P0
P2, T2, V2
M0

3/3
________________________________________________________________________________________________________
Formulaire
Cadre d’étude :
Système fermé : pas d’échange de matière avec l’extérieur
Composition constante : pas de réaction chimique
Travail = Travail des forces pressantes
Système à l’équilibre : Equilibre thermique : Text = T Equilibre mécanique : Pext = P
Premier principe :
Travail des forces pressantes :
Expressions de la variation de l’énergie interne :
Phase condensée : Gaz parfait (1ère loi de Joule) :
Enthalpie :
Transformation monobare (isobare) :
Expressions de la variation de l’enthalpie:
Phase condensée : Gaz parfait (2nde loi de Joule) :
Second principe :
avec
Expressions de la variation d’entropie:
Phase condensée :
Gaz parfait :
Lois de Laplace (transformation adiabatique réversible = isentropique, GP) :
ou ou
1
/
3
100%