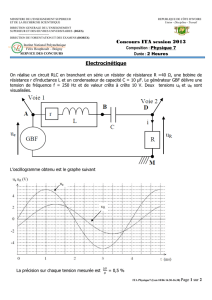
Exercices de thermodynamique I - Université Kasdi Merbah Ouargla

Université Kasdi Merbah Ouargla
Faculté des sciences et technologies et sciences de la matière
Département des hydrocarbures et de chimie
Travaux dirigé de thermodynamique Prof : Ali Zerrouati
…………………...……………....…………………...……………....………………………….
TDII - 2emeProduction - LMD Hydrocarbure
I - Quelle quantité de chaleur faut il dépenser pour échauffer une masse m= 5Kg de méthane
(CH4) de 15°c à 1215°c.
a - à volume contant
b - à pression constante
On donne la chaleur spécifique molaire moyenne du méthane : Cp = 0,036Kj/mole °.
Rapport des chaleurs spécifiques : γ = 1,3
II - Un cylindre verticale fermé par un piston renferme un gaz (Figure ci-dessus). La section du
piston est de A= 500mm2. Le piston est sollicité par une force externe verticale de F= 20N.
Quelle est la masse du piston si la pression absolue du gaz atteindra pab = 180KPa.
Calculer le travail développé dans le cylindre si la variation du volume du gaz est de 0,25l.
L’accélération de la pesanteur : g =9,81m/s2.
III – Une masse d’air parfait m = 1,5Kg subit un échauffement de t1= 20°c à 65°c. La pression
initiale du gaz est de p1 = 1bar. Rapport des chaleurs spécifiques de l’air : γ = 1,4
Le système étant fermé.
Dans les deux cas suivants :
1 – transformation isochore
2 - transformation isobare
Calculer :
Le volume initiale, Le volume et a pression final du gaz
Le travail W12, la variation de l’énergie interne, la quantité de chaleur et la variation de
l’enthalpie du gaz.
F = 20N
Gaz
Piston

IV - Un cylindre fermé par un piston contient un volume d’azote V1= 1,57m3 à la pression p1=
120 KPa et la température t1 = 25°c. On repousse le piston dans le cylindre jusqu’à ce que la
pression atteint p2= 1,3MPa à t2= 160°c.
Calculer la masse et variation de l’énergie interne du gaz parfait.
Si le travail de compression W12 est de 17Kj, calculer la quantité de chaleur dégagée par le gaz.
V– Un cylindre de diamètre D=200mm enfermé par un piston, contient une quantité d’azote à la
pression p1= 3bars absolue à la température t1 = 35°c. Le piston qui se trouvait à une profondeur
de 100mm du fond du cylindre se déplace et stoppe après une course de 100mm. Le gaz est
parfait et la transformation est considérée isotherme.
Calculer :
1 – Le travail développé par le gaz.
2 – La variation de l’énergie interne, et la variation de l’enthalpie du gaz
3 – La quantité de chaleur mis en jeu
4 – représenter l’air associé au travail développé par le gaz sur un diagramme de Clapeyron.
On donne Cp= 0,24 Kcal/Kg ° et γ = 1,4
VI – un cylindre fermé par un piston mobil renferme de l'Hélium parfait dans les conditions ( P1,
V1). On opère une détente adiabatique qui amène le gaz à l'état ( P2 , V2 ). On donne P1 = 5bars,
P2 = 1bar, V1=3,8 1itres, le rapport adiabatique γ= 1,4 et MHe = 4gr.
Calculer :
1 – Le volume du gaz V2.
2 – Le travail de détente W.
3 – Les variations de l'énergie interne et de l'enthalpie du gaz
4 – Représenter la transformation et l'air associé au travail de détente dans un diagramme de
Clapeyron.
VII - refaire l'exercice VI pour le cas d'un système ouvert.
a / Transformation adiabatique.
b / Transformation polytropique de coefficient n= 1,3.
1
/
2
100%