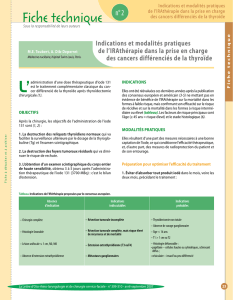
Traitement par iode 131 des cancers de la thyroïde. Vers une

Traitement par iode 131 des cancers de
la thyroïde. Vers une modulation des
doses ?
Par le Dr. Dominique Tassy
(Centre Jean Bernard – LE MANS)
L’ablation des reliquats thyroïdiens par iode 131 après chirurgie des cancers de la thyroïde de
souche folliculaire reste un sujet de débat. Quelles indications? Quelles modalités? Quel impact
sur le pronostic ?
Trois études récentes, deux publiées dans le New England Journal of Medicine par
Schlumberger et al (1) et Mallick et al (2), une publiée dans le Journal of Clinical Endocrinology
and Metabolism par Clerc et al (3) abordent la question de l’utilisation de faibles doses d’iode
131 dans les cancers de la thyroïde à faible risque.
Le terme de dose prête en fait à confusion. Il ne s’agit en aucune façon de la dose absorbée par
la cible à irradier, en pratique inconnue, ou au mieux appréciée très grossièrement. Il s’agit de la
dose au sens de posologie, de quantité de radioactivité administrée et le terme d’activité
exprimée en Bq ou Ci serait mieux adapté.
L’activité de 3,7 GBq a été longtemps l’activité traditionnellement administrée aussi bien en
« ablation » post-opératoire qu’en traitement d’une maladie résiduelle correspondant dans l’unité
historique à 100 mCi, ce qui montre bien le caractère empirique du choix d’un ordre de grandeur
arrondi. L’utilisation d’une activité moindre de 1,1 GBq (30 mCi) n’est pas récente et a eu un
succès outre-atlantique pour des raisons réglementaires. Il s’agit en effet de la valeur-seuil qui
permettait aux Etats-Unis une administration ambulatoire et un accès facilité pour les médecins
endocrinologues. Quant à l’activité de 0,74 GBq (20 mCi), elle répond dans d’autres pays, dont
la France, à la valeur-seuil permettant également une administration ambulatoire.
Néanmoins, des considérations plus fortes que ces aspects pratiques et réglementaires amènent
à s’intéresser à ces faibles activités. D’une part, l’impact sur la survie du traitement par iode 131
des cancers de la thyroïde à faible risque (T1-T2, N0-Nx) n’est pas démontré (4). L’intérêt
essentiel est de permettre une surveillance plus aisée par le dosage de la thyroglobuline (Tg) et
d’établir un pronostic plus précis (5), les patients obtenant après ablation par iode 131 un taux de
Tg bas en dessous d’un seuil de l’ordre de 1 ng/ml sous stimulation par la TSH humaine
recombinante (rhTSH) ayant un risque de récidive inférieur à 1 % (6).

D’autre part, le risque de second cancer apparaît plus élevé après administration d’iode 131 (7) y
compris chez les patients traités pour un cancer à faible risque (T1 N0) et plus particulièrement
chez les patients de moins de 45 ans (8). Il est donc légitime, chez les patients à faible risque,
en particuliers jeunes, d’essayer de trouver la plus faible activité permettant une ablation des
reliquats thyroïdiens.
Les études rapportant l’efficacité des activités de 30 mCi d’iode 131 sont pour beaucoup
anciennes et pénalisées de la non prise en compte de la sidération thyroïdienne liée à la
réalisation d’une scintigraphie diagnostique à l’iode 131 préalablement à l’administration
thérapeutique (9), pratique maintenant abandonnée.
Un autre élément à prendre en considération est la disponibilité maintenant large de la rhTSH,
en alternative du sevrage de l’hormonothérapie, permettant d’éviter les manifestations
d’hypothyroïdie, mais également, à activité égale administrée, une irradiation corps entier
moindre (10). Des études précédentes ont déjà montré l’équivalence de 100 mCi sous sevrage
et de 100 mCi sous rhTSH (11) puis de 100 mCi sous rhTSH et 50 mCi sous rhTSH (12).
Le dosage de la thyréoglobuline post-chirurgical avant stimulation :
élément prédictif d’efficacité ?
Les deux études de Schlumberger et al (1) et Mallick et al (2) sont construites de façon
rigoureuse et fort semblable : chez des patients ayant été opérés d’un cancer de la thyroïde de
souche folliculaire, considérés à faible risque, comparaison prospective et randomisée de 4
bras : 30 mCi ou 100 mCi, chacun des deux dosages pouvant être administré sous stimulation
de la TSH endogène par sevrage de l’hormonothérapie ou en continuation de l’hormonothérapie
avec administration de rhTSH.
L’étude de Clerc et al (3) porte sur l’utilisation d’activités d’iode 131 encore plus faibles, de 20
mCi. Il s’agit de l’analyse rétrospective d’un protocole consistant en 2 administrations à 6-18
mois d’intervalle de 20 mCi, soit sous sevrage, soit sous rhTSH mais sans randomisation.
L’intérêt d’une double administration systématique est discutable, par contre il est intéressant
d’étudier les effets à 6-18 mois de la première administration.
Les critères d’ablation diffèrent entre les 3 études et sont une combinaison de données obtenues
au-delà de 6 mois : 1) scintigraphique : scintigraphie blanche ou taux de fixation en dessous
d’une valeur-seuil ; 2) biologique : Tg basse sous stimulation par la rhTSH et 3) échographique.
Le problème des patients ayant des auto-anticorps anti-Tg est traité différemment dans les 3
études. Une comparaison homogène des données peut toutefois être faite, en excluant les
patients avec auto-anticorps anti-Tg et en retenant uniquement les critères biologiques, (Tg sous
rhTSH < à 1 ng/ml (1) (3), ou < à 2 ng/ml (2)) retouvant globalement des taux d’ablation de 96%,
87% et 80% respectivement dans les études de Schlumberger et al (1), Mallick et al (2) et Clerc
et al (3).
Statistiquement, les différences de taux d’ablation observées entre les 4 groupes (30 vs 100 mCi
, sevrage vs rhTSH), dans chacune des 2 études de Schlumberger et al (1) et Mallick et al (2)
ont été retrouvées inférieures à 10 % pour un intervalle de confiance de 95%. Il est noté une
efficacité très légèrement supérieure des 2 groupes 100 mCi sur les 2 groupes 30 mCi, + 1,6%
chez Schlumberger et al (1), + 2,9% chez Mallick et al (2). Les différences sevrage vs rhTSH
sont encore plus minimes et non univoques : + 0,7% chez Schlumberger et al (1), - 1,4% chez
Mallick et al (2). Clerc et al (3), quant à eux, retrouvent une meilleure efficacité, statistiquement
significative, de la rhTSH sur le sevrage, mais sur des groupes non randomisés.

C’est dans l’étude rapportant le taux d’ablation le plus élevé (1) que l’on note la proportion la plus
élevée de patients ayant avant toute administration d’iode 131 une Tg basse : Tg sous rhTSH <
1 ng/ml chez 55% des patients, Tg sous sevrage < 1 ng/ml chez 38 % des patients, témoignant
de thyroïdectomies très complètes avec de faibles volumes des reliquats thyroïdiens. En
comparaison, ces proportions étaient, sous sevrage comme sous rhTSH de l’ordre de 25% dans
les 2 autres études (2,3).
Point également intéressant, les patients ayant un taux de Tg > 10, dans le bras rhTSH comme
dans le bras sevrage, dans l’étude de Clerc et al (3) avaient un taux d’ablation de 51% vs 85%
chez les patients sont de taux de Tg était < 10. Il convient de préciser qu’il s’agissait de Tg sous
stimulation et avec un possible effet d’augmentation de la Tg par radiolyse (13) chez les patients
du groupe rhTSH dont la Tg a été mesurée dans cette étude quelques jours après
l’administration de l’iode 131 contrairement aux 2 autres études (1,2) réalisant le dosage le jour
de l’administration de l’iode 131.
Dans la pratique c’est bien le dosage de la Tg post-chirurgical avant toute stimulation qui pourrait
être un élément prédictif d’efficacité.
Vers une utilisation de plus faibles doses d’iode 131
En conclusion provisoire, ces 3 études montrent que l’on peut attendre des taux d’ablation
élevés avec l’utilisation de faibles activités d’iode 131. En matière d’ablation de reliquats
thyroïdiens l’utilisation de la rhTSH semble aussi efficace que le sevrage, même si la question
reste débattue pour le traitement des métastases (14). L’équivalence d’efficacité par contre est
moins certaine entre les activités utilisées et le volume des reliquats thyroïdiens post-
chirurgicaux pourrait jouer un rôle significatif dans le taux de succès.
Le concept de cancer de la thyroïde à faible risque, objet des 3 études était assez large avec
des critères d’inclusion variables : T1 N0 ou Nx (3), T1 tout N, T2 N0 (1) ou T1-T3 tout N (2).
Dans les 3 études, étaient exclus les sous-types histologiques agressifs et les patients
métastatiques. Les patients T1<10 mm N0 pour Schlumberger et al (1) et T1 < 5mm N0 pour
Clerc et al (3) étaient réputés ne pas relever d’une indication d’iode 131, soit un panel allant de
T1 5mm N0 à T3 N1.
Il est clair que le challenge d’une ablation efficace est d’autant plus important que les facteurs
pronostiques, à l’intérieur de ce large groupe dit à faible risque, sont moins favorables. Jusqu’à
récemment, la discussion post-chirurgicale était très dichotomique : abstention thérapeutique ou
traitement par iode 131 par le protocole traditionnel 100 mCi-sevrage.
Cette possibilité d’utilisation de faibles activités va peut-être amener à une modulation des
décisions, qu’il faudra codifier, entre 0, 20, 30, 50 ou 100 mCi, en privilégiant la rhTSH qui ne
semble pas moins efficace et permet à activité égale une moindre irradiation corps entier, avec 3
éléments à considérer :
Facteurs pronostiques de la maladie,
Age du patient, non pas uniquement en tant que facteur pronostique propre, mais comme
susceptibilité d’effet délétère à long terme de l’irradiation,
Appréciation du volume des reliquats post-chirurgicaux.

Mise Au Point 1
Références
1. Schlumberger M, Catargi B, Borget I, Deandreis D, Zerdoud S, Bridji B, et al. Strategies of radioiodine ablation
in patients with low-risk thyroid cancer. N. Engl. J. Med. 2012 mai 3;366(18):1663-73.
2. Mallick U, Harmer C, Yap B, Wadsley J, Clarke S, Moss L, et al. Ablation with low-dose radioiodine and
thyrotropin alfa in thyroid cancer. N. Engl. J. Med. 2012 mai 3;366(18):1674-85.
3. Clerc J, Bienvenu-Perrard M, de Malleray CP, Dagousset F, Delbot T, Dreyfuss M, et al. Outpatient thyroid
remnant ablation using repeated low 131-iodine activities (740 MBq/20 mCix2) in patients with low-risk
differentiated thyroid cancer. J. Clin. Endocrinol. Metab. 2012 mars;97(3):871-80.
4. Schvartz C, Bonnetain F, Dabakuyo S, Gauthier M, Cueff A, Fieffé S, et al. Impact on overall survival of
radioactive iodine in low-risk differentiated thyroid cancer patients. J. Clin. Endocrinol. Metab. 2012
mai;97(5):1526-35.
5. Castagna MG, Maino F, Cipri C, Belardini V, Theodoropoulou A, Cevenini G, et al. Delayed risk stratification,
to include the response to initial treatment (surgery and radioiodine ablation), has better outcome predictivity
in differentiated thyroid cancer patients. Eur. J. Endocrinol. 2011 sept;165(3):441-6.
6. Brassard M, Borget I, Edet-Sanson A, Giraudet A-L, Mundler O, Toubeau M, et al. Long-Term Follow-Up of
Patients with Papillary and Follicular Thyroid Cancer: A Prospective Study on 715 Patients. Journal of Clinical
Endocrinology & Metabolism. 2011 mars 9;96(5):1352-9.
7. Sawka AM, Thabane L, Parlea L, Ibrahim-Zada I, Tsang RW, Brierley JD, et al. Second primary malignancy
risk after radioactive iodine treatment for thyroid cancer: a systematic review and meta-analysis. Thyroid. 2009
mai;19(5):451-7.
8. Iyer NG, Morris LGT, Tuttle RM, Shaha AR, Ganly I. Rising incidence of second cancers in patients with low-
risk (T1N0) thyroid cancer who receive radioactive iodine therapy. Cancer. 2011 oct 1;117(19):4439-46.
9. Park HM, Perkins OW, Edmondson JW, Schnute RB, Manatunga A. Influence of diagnostic radioiodines on
the uptake of ablative dose of iodine-131. Thyroid. 1994;4(1):49-54.
10. Hänscheid H, Lassmann M, Luster M, Thomas SR, Pacini F, Ceccarelli C, et al. Iodine biokinetics and
dosimetry in radioiodine therapy of thyroid cancer: procedures and results of a prospective international
controlled study of ablation after rhTSH or hormone withdrawal. Journal of Nuclear Medicine. 2006;47(4):648-
54.
11. Pacini F. Radioiodine Ablation of Thyroid Remnants after Preparation with Recombinant Human Thyrotropin in
Differentiated Thyroid Carcinoma: Results of an International, Randomized, Controlled Study. Journal of
Clinical Endocrinology & Metabolism. 2005 déc 29;91(3):926-32.
12. Pilli T, Brianzoni E, Capoccetti F, Castagna MG, Fattori S, Poggiu A, et al. A Comparison of 1850 (50 mCi)
and 3700 MBq (100 mCi) 131-Iodine Administered Doses for Recombinant Thyrotropin-Stimulated
Postoperative Thyroid Remnant Ablation in Differentiated Thyroid Cancer. Journal of Clinical Endocrinology
& Metabolism. 2007 sept 1;92(9):3542-6.
13. Muratet JP, Giraud P, Daver A, Minier JF, Gamelin E, Larra F. Predicting the efficacy of first iodine-131
treatment in differentiated thyroid carcinoma. J. Nucl. Med. 1997 sept;38(9):1362-8.
14. Taïeb D, Jacob T, Zotian E, Mundler O. Lack of efficacy of recombinant human thyrotropin versus thyroid
hormone withdrawal for radioiodine therapy imaging in a patient with differentiated thyroid carcinoma lung
metastases. Thyroid. 2004 juin;14(6):465-7.
1
/
4
100%





![PDF [2iMo]](http://s1.studylibfr.com/store/data/004094110_1-9c38ac884b991692899d8d7de16087a9-300x300.png)



