Chimie organique – Corrigé

Université du Maine - Faculté des Sciences ⌫ Retour LCU7 – Chimie Organique : Corrigé Sept 2002
Chimie organique – Corrigé
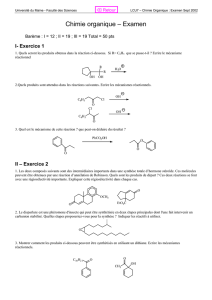
I- Exercice 1
1. C'est une transposition pinacolique. Si R = C6H5, la seconde voie conduit à un carbocation intermédiaire mieux stabilisé
donc la cyclohexanone sera majoritaire.
RR
OH OH
H3O
RR
OH2OH
R
R
OH
R
COR
R
R
OH OH2
RR
O
H
RR
O
2. Ces produits donneront une transposition de Favorski. Les deux chlorocétones conduisent à la même cycopropanone ;
l'ouverture se fera avec formation deu carbanion benzylique mieux stabilisé.
C6H5Cl
O
OH
C6H5O
Cl OH
C6H5Cl
O
C6H5O
Cl
C6H5
OCOOH
C6H5
OH
C6H5O
O
3. C'est une trasposition de Bayer-Villiger. Le résultat montre que le groupe phényle est un meilleur groupe migrant que le
groupe éthyle.
O
PhCO2OH
O
O
OO-O-COPh
H
OO
H
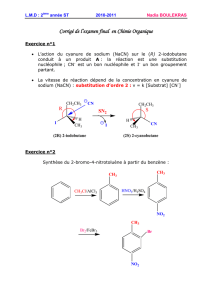
II – Exercice 2
1.Les pointillés rouges montrent où se sont formées les liaisons.
OCH3
O
O
EtO2C
OCH3
OO
+
O
O
CO2Et
+
carbanion benzylique
carbanion stabilisé par deux effets -M

Université du Maine - Faculté des Sciences ⌫ Retour LCU7 – Chimie Organique : Corrigé Sept 2002
2. Un alcène est un précurseur d'époxyde. L'alcène lui même peut être préparer par une réaction de Wittig qui fait intervenir un
carbanion : un ylure. Cet ylure est obtenu par traitement du sel de phosphonium par une base appropriée. Deux combinaisons
sont possibles. Un peracide permet ensuite d'époxyder la double liaison.
O
(C6H5)3PX
O
O
X
(C6H5)3P
3. Ces deux réactions font intervenir une inversion de polarité grâce aux dithianes.
C10H21 O
O
HS-(CH2)3-SH
BF3
S
S
BuLi S
S
1) X-C10H21
2) HgCl2
L'autre combinaison qui ferait intervenir un halogènure de phényl est probablement moins favorable.
OH
O
CH3
O
CH3
HS-(CH2)3-SH
BF3
SS
CH3
BuLi SS
CH3
O
1)
2) HgCl2
3) H
4.
O
O
COOMe
OMeO
OH
HO
COOMe
MeO OMe
O
O
OMe
O
O
COOMe
O
O
O
COOMe
O
III – Exercice 3
1.

Université du Maine - Faculté des Sciences ⌫ Retour LCU7 – Chimie Organique : Corrigé Sept 2002
R
R
Z,Z,Z,Z
+
O
O
conrotatoire
fermeture
8e
disrotatoire
fermeture
6e R
R
cycloaddition
4n+2
Diels Alder
R
R
O
O
rétroDA
R
RR
R
ouverture
4e
conrotatoire
10 11
12 13 14
H
H
2. La synthèse de l'occidentalol fait intervenir successivement, une réaction de DA et une réaction de rétroDA.
O
CO2Et
O+
O
∆
67
5
Occidentalol
O
EtO2C
O
O
=O
O
EtO2C
O
CO2Et O
Diels Alder
+ rétro DA
CO2Et O
O
Protection C=O
8
CH2OH O
O
Réd
9
CH2OTs O
O
Estéri.
10
CH3O
O
Réd. Déprotection
11
CH3
OCH3
CH3
HOH
On notera que la jonction cis entre les deux cycles provient de la stéréospécificité de la réaction de DA
1
/
3
100%