Chimie organique - 2000 - Chimie - partiel

HEI 3 GC Le 9 février 2000
Devoir n°1
Durée : 1 heure 30
Sans document
Sans calculatrice
Chimie Organique
(P. Gautret)
SYNTHESE D’INSECTICIDES
Le pyrèthre, poudre de chrysanthème séchée, est un insecticide naturel connu depuis des
siècles. De l’étude des composés actifs du pyrèthre est née la série chimique des
pyréthrénoïdes de synthèse dont le squelette de base est l’acide chrysanthémique. Ces
insecticides sont connus pour leur action rapide et leur faible toxicité envers les mammifères.
Dans ce problème, diverses voies d’accès à cette famille chimique sont étudiées.
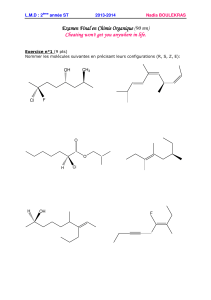
Exercice 1
N N CH CO2Et
CO2Et
E
D(1 équivalent)
H+, ∆
(-2 H2O)
C
CCH
H
B
A
H2 / Pd (2 équivalents)1) NaNH2 (2 équivalents)
2) (CH3)2C=O (2 équivalents)
3) H+ / H2O
1.1- Etape A → B
• Donner le nom usuel de A et de (CH3)2C=O.
• Justifier le caractère acide des alcynes monosubstitués.
• Donner la structure de B en précisant son mécanisme de formation.
1.2- Etapes B → D
• Déterminer la structure de C et de D (C8H14).
Détailler le mécanisme de formation de D.
• Indiquer les principales caractéristiques d’une hydrogénation catalytique.
1.3- Etape D → E
• Lors de l’étape D → E, se transforme en carbène CH-
CO2Et. Ecrire le mécanisme de cette transformation et préciser la structure de Lewis de
CH-CO2Et. Est-ce un réactif nucléophile ou électrophile ?
N N CH CO2E
t
• Préciser le mécanisme de la réaction D → E.
1/4

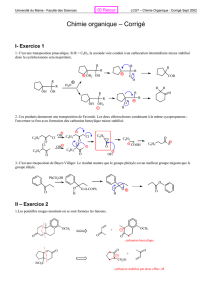
Exercice 2
?
JCl
CO2Et
?
OH
CO2Et
I
?
ECO2Et
HO
O
O
G
F
CH3MgBr
(1 équivalent)
1) Base
2) ClCH2CO2Et
2.1- Etape F → G
• Donner le nom IUPAC de F.
Quel site de F peut être le plus facilement déprotoné ? Justifier en écrivant les formes
mésomères du carbanion correspondant.
• Donner la structure de G en précisant son mécanisme de formation.
2.2- Etape G → H
• Quel(s) solvant(s) utilise-t-on généralement pour réaliser des réactions avec des
organomagnésiens ? Quel est le rôle de ce solvant ? Quelles précautions expérimentales
doit-on prendre ?
• Une cétone réagit-elle plus facilement qu’un ester vis-à-vis d’un organomagnésien ?
Préciser la structure des composés obtenus dans ces deux cas et indiquer le mécanisme
de ces deux réactions.
• Décrire le mécanisme de formation de H à partir de G.
2.3- Etapes H → E
• Proposer des réactifs permettant de réaliser les étapes H → I, I → J et J → E.
• Détailler les mécanismes des réactions H → I et J → E.
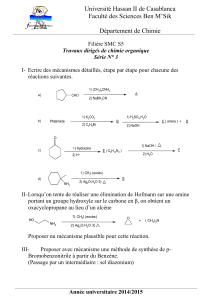
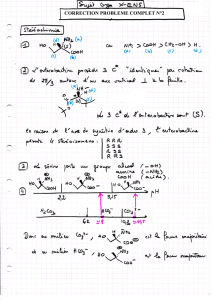
Exercice 3 : synthèse stéréospécifique de l’acide (+) trans chrysanthémique (O1)
1)
2) Filtration
3) H+ / H2O
O1
H
HCO
2H1) KOH / H2O
2) H+ / H2O
CO2Et
CO2Et
N
Base
M
SO2K
LBr
K
HBr
E
O
O2N
NMe2
HOH
HOH2CH
P
3.1- Structure de l’acide (+) trans chrysanthémique (O1)
• Combien de stéréoisomères de configuration possède l’acide (+) trans chrysanthémique (O1)
?
2/4

Les représenter en indiquant ceux qui sont énantiomères et ceux qui sont
diastéréoisomères.
• Déterminer la configuration absolue des carbones asymétriques de O1.
3.2- Etape K → L
• Donner le nom usuel de K.
• Indiquer le mécanisme de la réaction K → L.
Quel isomère de L, nommé L’, est également obtenu lors de ce traitement de K par le
bromure d’hydrogène ? Quel facteur favorise la formation de L par rapport à L’ ?
3.3- Etape L → M
• Donner la structure de M.
• Décrire le mécanisme de formation de M.
3.4- Etapes M → E
• Soit un composé de formule (CH3)2C=CH-CH2-Z avec Z = CHO, COR, NO2, SO2R ;
quel rôle électronique joue Z ?
Déterminer la structure du sel N obtenu lors du traitement de M par une base forte.
• Quels sont les deux types d’addition possible que (CH3)2C=CH-CO-R’ peut subir en
présence d’un nucléophile ? Décrire le mécanisme mis en jeu avec RLi, puis avec
R2CuLi.
• Sachant que l’attaque nucléophile de N sur (CH3)2C=CH-CO2Et se fait de manière
analogue à celle de R2CuLi sur (CH3)2C=CH-CO-R, décrire de manière très détaillée le
mécanisme de formation du composé E (seuls les deux stéréoisomères trans sont
obtenus sous forme racémique pour des raisons stériques).
3.5- Etapes E → O1
• Donner la structure du produit O. Préciser le mécanisme mis en jeu lors du traitement
de E par de la potasse.
• L’action de P (dérivé diméthylé du chloramphénicol) sur le racémique O (mélange des
énantiomères O1 et O2) conduit à la précipitation du sel de l’acide (+) trans
chrysanthémique O1 et à une solution contenant le sel de l’autre énantiomère O2.
Quelle réaction se produit-il ? Expliquer pourquoi elle permet de séparer les deux
stéréoisomères.
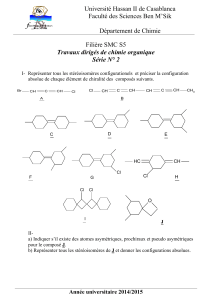
3.6- Transformation de O2 (énantiomère de O1) en O1
Les étapes ci-dessous permettent de transformer O2 en son énantiomère O1.
Q
O3 / Zn
O2Inversion de la
configuration
du carbone C2
R S
P(C6H5)3Inversion de la
configuration
du carbone C1
H
HCO
2H
O1
21
Dans le cycle a 3 carbones de O1 et O2, le carbone porteur de la fonction acide est noté C1
et le carbone porteur du groupe méthylpropényl est noté C2.
• Déterminer la structure de Q, R et S.
• Préciser le mécanisme de la réaction R → S.
--------------------
Barème indicatif :
3/4
1- 5 points : 1.1- 2,5 pts 1.2- 1,5 pt 1.3- 1 pt
2- 6,5 points : 2.1- 2 pts 2.2- 2,5 pts 2.3- 2 pts

4/4
3- 8,5 points : 3.1- 1,5 pt 3.2- 1,5 pt 3.3- 0,75 pt 3.4- 2 pts 3.5- 1,5 pt 3.6- 1,25 pt
1
/
4
100%