LE QUOTIENT DE REACTION

LE QUOTIENT DE REACTION
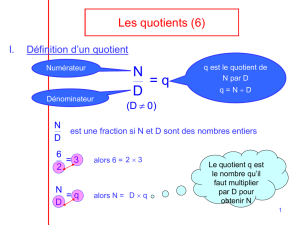
Le quotient de réaction est une grandeur (sans unité) qui permet connaître l’état d’avancement
d’une réaction chimique. Le quotient d’une réaction aA + bB = cC + dD est défini tel que :
[ ] [ ]
[ ] [ ]
c d
r
a b
C D
Q
A B
⋅
=⋅
Les concentrations [X] sont en mol.L
-1
et Qr n’a pas d’unités.
Si X est un solide ou de l’eau, on remplace [X] par 1.
> Le quotient de réaction à l’état initial d’une réaction est noté Qr,i :
[
]
[
]
[ ] [ ]
,
c d
i i
r i
a b
i i
C D
Q
A B
⋅
=⋅
le plus souvent, grâce à l’enoncé, on obtient cette expression :
( ) ( ) ( ) ( )
( ) ( ) ( ) ( )
,
c d
v v v v
T T
i i
r i
a b
v v v v
T T
i i
c C V C c D V D
V V
Qc A V A c B V B
V V
⋅ ⋅
⋅
=⋅ ⋅
⋅
> Le quotient de réaction à l’état final f (ou état d’équilibre éq) est appelé constante
d’équilibre de la réaction.
Chaque réaction à sa propre constante d’équilibre, notée K.
[ ] [ ]
[ ] [ ]
,
c d
éq éq
r éq
a b
éq éq
C D
K Q
A B
⋅
= = ⋅
Si Qr,i < K, alors la réaction aura lieu dans son sens direct.
Si Qr,i > K, alors la réaction aura lieu dans son sens indirect (ou inverse).
Si Qr,i = K, alors le système est dans son état d’équilibre.
Remarque : En chimie organique, l’eau n’est pas le solvant, il n’y a donc pas de
concentrations. Qr est alors calculé à partir des quantités de matière et non plus à partir des
concentrations.
APPLICATIONS :
- Exercices 3 P 123, 14 et 16 P 124
- Exercice résolu P 186
1
/
1
100%