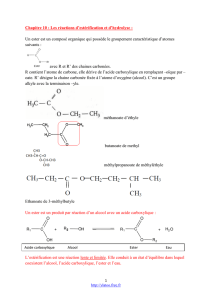
comp.D1

Complément. Critère d’évolution appliqué au rendement de
l’estérification (comp.D1)
Document à l’intention de l’enseignant dont le contenu n’est pas à développer avec les élèves.
Dans les commentaires du programme (BO, partie D1), il est dit : Concernant le contrôle de l’évolution
d’un système, un raisonnement qualitatif permet d’amener l’élève à concevoir que, le système étant à
l’équilibre, l’ajout d’un des réactifs ou l’élimination d’un des produits entraîne la diminution du quotient
de réaction, Qr et donc augmente le rendement de la transformation. L’une ou l’autre de ces
opérations met le système dans une situation où Qr,i est inférieur à K. Le système évolue donc dans le
sens direct.
Objectif
Aider l’enseignant à évaluer les limites du programme concernant le critère d’évolution appliqué
au rendement de l’estérification.
Expression du quotient de réaction
Équation de réaction : Alcool (R1OH) + Acide (R2CO2H) = Ester (R2CO2 R1) + Eau (H2O)
Cette situation est nouvelle pour l’élève puisque l’on n’est plus en solution aqueuse. En effet, lors de
la réaction entre l’acide et alcool, l’eau est un produit de réaction et n’a pas le statut de solvant,
comme c’était le cas le plus souvent jusqu’alors
1
. Il y a donc lieu de faire intervenir l’eau dans l’écriture
du quotient de réaction (alors que le solvant - l’eau en l’occurrence - n’apparaît pas dans l’écriture de
Qr).
L’expression du quotient de réaction utilisée en classe de terminale S pour cette situation est :
Qr =
(est) (eau)
.
(al) (ac)
.
nn
VV
nn
VV
En simplifiant par V, l’expression de Qr devient :
Qr =
(est). (eau)
(al). (ac)
nn
nn
Prenons l’exemple d’une réaction d’estérification faisant intervenir un alcool primaire : la constante
d’équilibre associée à la réaction vaut
2
K = 4.
Lorsque le système atteint l’état d’équilibre, le quotient de réaction s’écrit :
Qr,éq. =
éq. éq.
éq. éq.
(est) . (eau)
(al) . (ac)
nn
nn
= K
1
L’écriture de l’équation de réaction permet à l’élève de savoir si l’eau est solvant ou produit de réaction, car la
spécification (aq) indique que l’on est en solution aqueuse, par exemple : HA(aq) + H2O = A-(aq) + H3O+.
2
Et ce quelle que soit la température, puisque cette réaction est dite athermique.

On se demande alors comment augmenter le rendement de la transformation ?
1. Comment évolue le système si l’on ajoute un réactif ?
Si l’on ajoute une quantité d’acide carboxylique n1 par exemple, le système se trouve dans un nouvel
état initial pour lequel :
Qr,i =
éq. éq.
éq. éq. 1
(est) . (eau)
(al) .[ (ac) ]
nn
n n n
puisque [n(ac)éq. + n1] > n(ac)éq. alors Qr,i < K
Puisque Qr tend vers K, le système évolue dans le sens direct.
Le nouvel état d’équilibre chimique atteint alors est le même que si l’on avait mis la quantité d’acide
carboxylique totale dès le départ
3
.
2. Comment évolue le système si l’on élimine l’ester (ou l’eau) au fur et à mesure de sa formation ?
Si l’on élimine une quantité d’ester n2 par exemple, le système se trouve dans un nouvel état initial
pour lequel :
Qr,i =
éq. 2 éq.
éq. éq.
[ (est) ]. (eau)
(al) . (ac)
n n n
nn
puisque [n(est)éq.- n2] < n(est)éq. alors Qr,i < K
Le système évolue dans le sens direct.
3. Conclusion
Il est donc possible d’augmenter le rendement de la transformation soit en ajoutant une quantité de
l’un des réactifs, soit en éliminant l’un des produits formés au fur et à mesure de sa formation.
4. Remarque
Le raisonnement développé pour l’application à l’estérification du quotient de réaction n’est valable
qu’en milieu homogène. L’existence de plusieurs phases, situation à laquelle il est possible d’être
confronté expérimentalement, est beaucoup plus complexe à présenter.
3
Un exemple de calcul est proposé dans le document : Approfondissement. Critère d’évolution appliqué au
rendement de l’estérification, un exemple de calcul. Comp.D2.
1
/
2
100%