nutrition parenterale chez les carnivores domestiques

1
Ecole Nationale Vétérinaire de Toulouse ANNEE 2002 THESE: 02 - TOU3-4106
NUTRITION PARENTERALE CHEZ LES CARNIVORES DOMESTIQUES:
SYNTHESE BIBLIOGRAPHIQUE
ET ETUDE EPIDEMIOLOGIQUE DU STATUT NUTRITIONNEL
DES ANIMAUX HOSPITALISES A L'ENVT
___________________________
THESE
pour obtenir le grade de
DOCTEUR VETERINAIRE
DIPLOME D'ETAT
présentée et soutenue publiquement en 2002
devant l'Université Paul-Sabatier de Toulouse
par
Isabelle, Danièle, Suzanne LESPONNE
née le 21 Août 1975, à Tarbes
__________
Directeur de thèse: M. le Professeur Patrick Verwaerde
__________
JURY
PRESIDENT:
M. Jean-Paul Thouvenot Professeur à l'Université Paul-Sabatier de TOULOUSE
ASSESSEURS:
M. Patrick Verwaerde Professeur à l'Ecole Nationale Vétérinaire de TOULOUSE
M. Nathalie Priymenko Professeur à l'Ecole Nationale Vétérinaire de TOULOUSE

2
Remerciements
A Monsieur le Professeur Jean-Paul THOUVENOT
Professeur des Universités
Praticien hospitalier
Nutrition
Qu'il trouve ici l'expression de mes plus vifs remerciements, pour avoir accepté de présider ce
jury de thèse.
A Monsieur le Docteur Patrick VERWAERDE
Maître de Conférences de l'Ecole Nationale Vétérinaire de Toulouse
Anesthésie, Réanimation
Qu'il soit ici vivement remercié, tant pour l'initiation que pour le suivi de ce travail de thèse.
Un grand merci, pour sa disponibilité et sa gentillesse, au "vétérinaire de l'année 2002".
A Madame le Docteur Nathalie PRIYMENKO
Maître de Conférences de l'Ecole Nationale Vétérinaire de Toulouse
Alimentation
Qu'elle trouve ici mes plus sincères remerciements, pour son implication dans la mise en
place du travail expérimental et pour sa participation très active dans l'encadrement de la
partie bibliographique de cette thèse, mais aussi pour avoir accepté d'être l'assesseur de notre
thèse.

3
A mes parents,
Qu'ils trouvent ici l'expression de mon amour et de mes remerciements les plus sincères pour
leur soutien tout au long de ces années. Ils pourront désormais se consacrer pleinement à leur
patchwork d'activités!
A ma sœur Céline, que j'adore.
En Guyane ou ailleurs; bonne chance, de tout mon cœur!
A tous les autres membres de ma famille,
Pour leur affection et leur soutien.
A tous mes amis,
Fred (Le), Giovanni, Sylvie et Yves, Bibi, Carine, Anne, Anne-Cécile, Bastien, Zuzuth,
Yannick, toutes les Delphine(s) (Le Fût et les autres), Agnès, et les autres.
En remerciement de tous les bons moments passés ensemble (en TP ou ailleurs) et pour ceux
à venir…
A mes docteurs et poulots de week-end,
Et tout particulièrement Mathieu, Nanou, Sabrina, Tamara, ainsi que François et Rénato.
A Claire Besson,
Avec qui j'ai mené la partie expérimentale de cette thèse.
Et à Christian Roux,
Que je remercie pour sa contribution à l'apparition et au maintien d'une vocation.
A Stéphane, l'occuliste marseillais de mon coeur .

4
Table des matières
INTRODUCTION…………………………………………………………………………….9
1ère partie: La nutrition parentérale: synthèse bibliographique
I. INDICATIONS ET OBJECTIFS DE LA NUTRITION PARENTERALE…………..11
1. Objectifs de la nutrition parentérale…………………………………………………11
a) Conséquences d'un état de malnutrition……………………………………………………11
a)1. Adaptation au jeûne……………………………………………………………………11
a)2. Conséquences biochimiques d'un état de malnutrition……………………………...…13
a)3. Conséquences cliniques d'un état de malnutrition……………………………………..15
b) Objectifs de l'alimentation artificielle……………………………………………………...17
c) Objectifs de l'alimentation parentérale……………………………………………………..19
2. Indications de la nutrition parentérale……………………………………………….19
a) Indications d'un support nutritionnel…………………………………………….19
A. Critères liés aux commémoratifs…………………………………………………………..21
1. La perte de poids………………………………………………………………………...21
2. L'anorexie………………………………………………………………………………..21
2)a. Définition………………………………………………………………………………...21
2)b. Causes d'anorexie………………………………………………………………………..21
2)c. Interprétation de la durée d'anorexie…………………………………………………….23
B. Critères cliniques…………………………………………………………………………..24
1. L'examen clinique général………………………………………………………………24
2. L'estimation des réserves, le score nutritionnel…………………………………………25
3. Les situations à risque…………………………………………………………………...26
C. Critères biologiques………………………………………………………………………..27
1. L'albuminémie…………………………………………………………………………...27
2. L'évaluation des fonctions immunitaires………………………………………………...28
3. Autres paramètres utilisables à ce jour…………………………………………………..29
4. Les méthodes d'avenir en matière de critères biologiques chez les carnivores
domestiques……………………………………………………………………………...30
D. Approche multifactorielle………………………………………………………………….32
1. L'indice de Buzby ……………………………………………………………………….32
2. L'index nutritionnel pronostique………………………………………………………...32
b) Indications de l'alimentation parentérale………………………………………...33
b)1. Choix du type de support nutritionnel…………………………………………………...33
b)1.a) Présentation………………………………………………………………………….33
b)1.b) Stimulation de la prise volontaire de nourriture……………………………………..36
b)1.c) Alimentation forcée………………………………………………………………….37
b)2. Indications de l'alimentation parentérale………………………………………………...40
b)2.a) Indications de l'alimentation parentérale selon la cause du déficit nutritionnel……..40
b)2.b) Indications de l'alimentation parentérale selon les types d'affection………………..41
b)2.c) Indications comparées de la nutrition parentérale en médecine vétérinaire et en
médecine humaine…………………………………………………………………………….44

5
II. LES BESOINS NUTRITIONNELS DES CARNIVORES DOMESTIQUES……….50
Introduction…………………………………………………………………………………...50
1. Les besoins en eau……………………………………………………………………..51
a) Importance de l’eau……………………………………………………………….51
b) Provenance de l’eau dans l’organisme……………………………………………51
c) Elimination de l’eau………………………………………………………………52
d) Besoins quantitatifs en eau………………………………………………………..53
2. Les besoins énergétiques………………………………………………………………54
a) Préliminaire : définitions…………………………………………………………..54
b) Calcul des besoins énergétiques…………………………………………………..54
b)1. Calcul des besoins énergétiques de l’animal sain…………………………………….54
b)2. Calcul des besoins énergétiques de l’animal malade…………………………………55
c) Besoins énergétiques et soutien nutritionnel……………………………………...57
3. Les besoins azotés……………………………………………………………………...58
a) Importance et rôles des protéines………………………………………………….58
b) Métabolisme protéique…………………………………………………………….58
c) Les besoins azotés : aspects quantitatifs…………………………………………...59
c)1. Présentation…………………………………………………………………………...59
c)2. Apports recommandés chez les animaux malades..…………………………………..59
d) Besoins protéiques : aspects qualitatifs……………………………………….…..62
d)1. Présentation…………………………………………………………………………...62
d)2. Les acides aminés essentiels………………………………………………………….62
d)3. Les acides aminés conditionnellement essentiels…………………………………….64
e) Le rapport énergie / azote………………………………………………………….66
4. Les besoins en acides gras essentiels…………………………………………………68
a) Rôle et importance des AGE………………………………………………………..68
b) Besoins quantitatifs en AGE………………………………………………………...68
5. Les besoins en glucides………………………………………………………………...69
a) Importance et rôles des glucides…………………………………………………….69
b) Métabolisme glucidique…………………………………………………………….69
c) Besoins glucidiques; principes généraux……………………………………………70
6. Les besoins en minéraux, vitamines et oligo-éléments………………………………71
a) Rôle et importance des minéraux, vitamines et oligo-éléments…………………….71
b) Expression des besoins à l'entretien, lors d'alimentation parentérale……………….73
c) Variations des besoins selon les pathologies ……………………………………….74
III. MODE D'EMPLOI : PRATIQUE DE LA NUTRITION PARENTERALE……….75
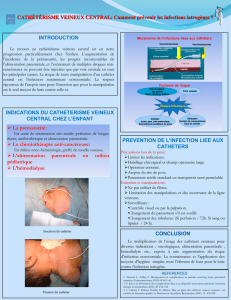
1. Les voies d'alimentation parentérale…………………………………………………..75
a) Les voies veineuses………………………………………………………………75
a)1. Les voies veineuses centrales……………………………………………………….75
a)2. Les voies veineuses périphériques…………………………………………………..75
b) Les autres voies………………………………………………………………….76
b)1. La voie intra-osseuse………………………………………………………………...76
b)2. La voie intra-péritonéale…………………………………………………………….76
2. Les produits d’alimentation parentérale………………………………………………..77
a) Les sources d’énergie…………………………………………………………….77
a)1. Les glucides………………………………………………………………………….77
a)2. Les alcools…………………………………………………………………………...80
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
1
/
210
100%