En route vers la médecine personnalisée

HIGHLIGHTS 2014 60
Pharmacologie
En route vers la médecine
personnalisée
Caroline Flora Samer
Service de Pharmacologie et Toxicologie cliniques, Centre Suisse de Toxicologie Humaine Appliquée, Hôpitaux Universitaires de Genève
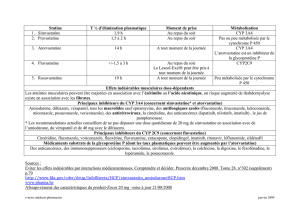
Polymorphismes génétiques
des cytochromes P450
métaboliseurs lents
métaboliseurs intermédiaires
métaboliseurs ultrarapides
©
SWISS MEDICAL FORUM – FORUM MÉDICAL SUISSE 2015;15(3):60–62

HIGHLIGHTS 2014 61
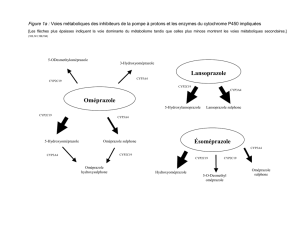
Helicobacter pylori
Tests diagnostiques mesurant l’activité
des cytochromes P450
Figure 1: Recommandations cliniques en présence de variations génétiques
dans l'activité des cytochromes P450.
SWISS MEDICAL FORUM – FORUM MÉDICAL SUISSE 2015;15(3):60–62

HIGHLIGHTS 2014 62
×
Conclusion
Conits d’intérêts
Références
SWISS MEDICAL FORUM – FORUM MÉDICAL SUISSE 2015;15(3):60–62
1
/
3
100%