Année Scolaire 2006-2007 Trimestre 1 http://membres.lycos.fr

Année Scolaire 2006-2007 Trimestre 1
http://membres.lycos.fr/abderrazekseddik/ Page 1/6
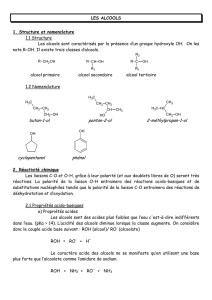
Propriétés chimiques des alcools
I- Introduction
La formule générale des alcools est . Lors des réactions, les
alcools procèdent soit par coupure de la liaison soit par coupure
de la liaison
♦ La liaison est une liaison covalente polarisée est fragile pour
l’alcool primaire. La mobilité de H diminue de l’alcool primaire à
l’alcool tertiaire.
♦ La liaison est une liaison covalente polarisée est plus
fragile pour l’alcool tertiaire. La mobilité de OH diminue de l’alcool
tertiaire vers l’alcool primaire.
II- Réactions communes
1/ Réaction de combustion : Combustion complète
a. Expérience
b. Analyse des résultats
Les produits de cette réaction
sont la vapeur d’eau et le dioxyde de carbone
Equation de la réaction
Les alcools donnent les mêmes produits pendant la combustion complète
R OH
O H
C OH
C OH
Eau de chaux
devient trouble
Gouttelettes
d’eau
Ethanol
C
2
H
6
O + 3O
2
2CO
2
+ 3H
2
O
O H

Année Scolaire 2006-2007 Trimestre 1
http://membres.lycos.fr/abderrazekseddik/ Page 2/6
2/ Réaction avec le sodium
L’expérience a été réalisée dans le T.P avec l’éthanol. La même
expérience peut se faire avec d’autres alcools d’autres classes.
Equation des réactions
Propan-1-olate de sodium
Propan-2-olate de sodium
2-méthylpropan-2-olate de sodium
Equation générale
3/ Réaction d’estérification
Définition
La réaction d’estérification est une réaction qui se produit entre un acide
carboxylique et un alcool. Les produits de la réaction ont l’ester et l’eau
Exemple
+ + H
2
O
éthanoate d’éthyle
La réaction d’estérification est une réaction limitée
CH
3
CH
CH
3
ONa
+ 2Na H
2
+ 2
CH
3
CH
2CH
3
OH
CH
2
CH
2
2CH
3
OH + 2Na H
2
+ CH
2
CH
2
2CH
3
ONa
CH
3
CH
3
C
2CH
3
OH
+ 2Na H
2
+ CH
3
CH
3
C 2CH
3
ONa
2R OH + 2Na H
2
+ 2R ONa alcoolate de sodium
C
O
O
H
CH
3
CH
3
CH
2
OH
C
O
O
CH
2
CH
3
CH
3

Année Scolaire 2006-2007 Trimestre 1
http://membres.lycos.fr/abderrazekseddik/ Page 3/6
II- Réaction distinctive
1/ Oxydation ménagée
a. Alcool primaire
Expérience
On introduit une spirale de cuivre préalablement
portée au rouge dans un bécher qui contient de
l’éthanol en ébullition. La couleur de la spirale
persiste.
Interprétation
Le réactif de schiff devient rose prouve l’apparition d’un aldéhyde : c’est
l’éthanal (odeur de pomme).
Le papier devient jaune indique la formation d’un acide.
La couleur de la spirale persiste prouve que la réaction est exothermique.
Equation de la réaction
2 + O
2
2 + 2H
2
O
2 + O
2
2
b. Alcool secondaire
+ O
2
Propanone
c. Alcool tertiaire
+ O
2
rien
CH
3
CH
2
OH
C
O
H
CH
3
C
O
H
CH
3
C
O
O
H
CH
3
Acide éthanoïque
CH
3
CH
2CH
OH CH
3
C 2 CH
3
O
CH
3
CH
3
C
2CH
OH

Année Scolaire 2006-2007 Trimestre 1
http://membres.lycos.fr/abderrazekseddik/ Page 4/6
2/ Oxydation par le dichromate de dipotassium
a. Expérience
b. Analyse des résultats
• Les mélanges contenus dans (a) et (b) deviennent verts, cette
couleur est due à la formation des ions Cr
3+
. Dons les deux
alcools ont été oxydés.
• Le contenu du tube (c) ne change pas de couleur, donc le 2-
méthylpropan-2-ol n’est pas oxydé.
• Le précipité jaune avec le D.N.P.H (2, 4-dinitrophénylhydrazine)
caractérise la présence du groupement fonctionnel qui peut
être soit un aldéhyde ou une cétone .
c. Equations des réactions
Oxydation de l’alcool primaire
2
2
(K
2
Cr
2
O
7
+ H
2
SO
4
2M)
Butan-1-ol Butan-2-ol 2- méthylpropan-2-ol
Réactif de schiff D.N.P.H
D.N.P.H
C
O
C
H
O
R
C
O
R
R’
CH
2
CH
3
OH + O
2
Aldéhyde ( Ethanal)
+ 2 H
2
O
C
H
O
2CH
C
H
O
CH
3
+ O
2
2CH
3
C
O
OH
Acide éthanoïque
+ 2H
2
O

Année Scolaire 2006-2007 Trimestre 1
http://membres.lycos.fr/abderrazekseddik/ Page 5/6
Equation bilan
Oxydation des alcools secondaires
Oxydation des alcools tertiaires
Les alcools tertiaires ne s’oxydent pas
3/ Réaction de déshydratation des alcools
a. Les alcools primaires
Déshydratation intermoléculaire
Les alcools se déshydratent assez facilement
pour donner des éthers dont l’odeur est très
caractéristique.
L’élimination de la molécule d’eau se fait à partir de deux molécules
d’alcools : c’est la déshydratation intermoléculaire.
Déshydratation intramoléculaire
L’élimination de la molécule d’eau se fait à partir d’une seule molécule
d’une d’alcool.
Mélange
d’éthanol
et H
2
SO
4
CH
2
CH
3
OH C H
2
CH
3
+ HO
CH
2
CH
3
C H
2
CH
3
O
H
2
SO
4
,
Eau de
brome
Mélange
d’éthanol
et H
2
SO
4
CH
3
CH 2CH
3
OH
CH
2
CH
3
OH + O
2
2CH
3
C
O
O
OH
+ O
2
CH
3
C
2CH
3
O
Cétone ( propane-2-one)
+ 2H
2
O
 6
6
1
/
6
100%