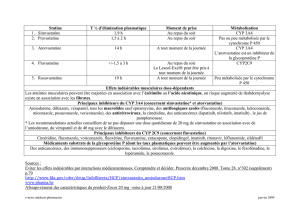
Interaction avec le télaprévir

Éditeur :
Morris Sherman M.D. B.Ch. Ph.D. FRCP(C)
Professeur agrégé de médecine
Université de Toronto
Les inhibiteurs de la protéase dans le
traitement contre le virus de l’hépatite C :
Mise à jour
Chapitre 2 –Interactions médicamenteuses importantes avec
des inhibiteurs de la protéase du virus de l’hépatite C en
monoinfection ou en coinfection avec le VIH
Novembre 2012

Interactions médicamenteuses importantes avec
des inhibiteurs de la protéase du virus de
l’hépatite C en monoinfection ou en coinfection
avec le VIH
Alice Tseng, Pharm.D., FCSHP, AAHIVP
Hôpital général de Toronto
Université de Toronto

Aperçu
Passer en revue les principes des interactions
médicamenteuses
Comprendre comment la pharmacologie des AAD
contribue aux interactions médicamenteuses
Mettre l’accent sur les principales interactions
médicamenteuses avec les agents contre le VHC
Décrire une stratégie d’identification et de prise en
charge des interactions médicamenteuses
Identifier des ressources pertinentes sur les
interactions médicamenteuses avec des agents
contre le VHC

Interactions médicamenteuses
Pharmacodynamique
Variation de l’effet pharmacologique d’un médicament
Activité ou toxicité additive, synergique ou antagoniste
p. ex., ribavirine + AZT =
anémie
Pharmacocinétique
Variation de la quantité de médicament(s) dans
l’organisme
L’absorption, la distribution, le métabolisme et
l’élimination peuvent être touchés
Les transporteurs ou le CYP450 y participent souvent

Interactions touchant le métabolisme des
médicaments
La majorité des médicaments sont transformés en formes inactives avant
l’élimination par le biais de réactions de phase I (oxydation) ou de phase II
(conjugaison)
Le cytochrome P450 est principalement responsable des réactions de
phase I
Superfamille d’enzymes microsomiques à hème
Principalement situées dans le foie et l’intestin grêle; se trouvent aussi
dans les reins, les poumons et le cerveau
Le CYP 3A4, l’isoenzyme la plus exprimée, participe au métabolisme
d’environ 50 % des médicaments utilisés à des fins cliniques
Autres : CYP 2D6, 2C9, 2B6, 1A2, etc.
Glycoprotéine P
Transporteur transmembranaire d’expulsion qui empêche l’accumulation
des médicaments à l’intérieur des cellules; agit sur une vaste gamme de
substrats. L’inhibition ou l’induction de cette protéine peut provoquer des
variations significatives de l’exposition au médicament
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
1
/
28
100%