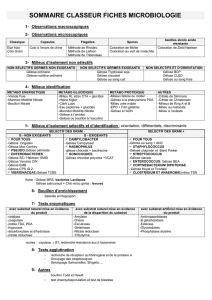
poly TP 2017

UFR Pharmacie - DFGSP3 UE7
Travaux pratiques de bactériologie
Objectif :
Une souche bactérienne cultivée sur milieu gélosé et en bouillon est distribuée à chaque étudiant.
Vous devez réaliser l’identification phénotypique de cette souche bactérienne en réalisant les tests
proposés ci-dessous.
1 – Observation microscopique après coloration de Gram
Réaliser des frottis sur une lame propre :
1) à partir de la culture en bouillon (bien remettre les bactéries en suspension avant de
prélever une goutte et la déposer sur la lame)
2) à partir de la culture sur milieu gélosé (déposer préalablement une goutte d’eau distillée
(ED) stérile à l’aide d’une pipette avec cône jaune puis dilacérer une colonie à l’intérieur)
Laisser sécher les frottis à côté de la flamme
Fixer le frottis (3 aller-retours rapides dans la flamme)
Laisser refroidir puis procéder à la coloration de Gram
Coloration de Gram :
- Violet de Gentiane : 1 min
- Lugol : 1 min
- Alcool et rinçage rapide à l’eau
- Fushine de Zielh diluée sur la lame : 1 min
- Rinçage à l’eau
Laisser sécher près de la flamme
Après séchage complet, ajouter une goutte d’huile à immersion
Observer la morphologie (cocci, bacilles), taille, couleur (violet si Gram positif, rose si Gram négatif)
et groupements cellulaires (seulement sur la coloration réalisée à partir de la culture en bouillon et
seulement pour les cocci) : diplocoques, tétrades, chaînettes, amas ou grappes de raisin… ) avec
l’objectif à immersion x 100.
Après observation, jeter les lames dans la poubelle de paillasse.

2 – Identification des bacilles à Gram négatif (le cas échéant)
1) Test d’orientation : recherche de la cytochrome oxydase (enzyme de la chaine respiratoire
bactérienne)
Imprégner un disque stérile avec une goutte de réactif et y écraser une colonie à l’aide d’un
ensemenceur. Après 30 secondes :
- Si apparition d’une coloration violette : la bactérie possède une cytochrome oxydase = Oxydase (+)
= Non entérobactérie = Pseudomonas, Vibrio, Aeromonas, …
- Si aucune coloration violette n’apparait : la bactérie ne possède pas de cytochrome oxydase =
oxydase (-) = Entérobactérie.
2) Tests biochimiques d’identification : inoculation d’une galerie API (Biomérieux)
Galerie API = système standardisé utilisé pour l’identification bactérienne.
Si oxydase (-) :
- Préparer une suspension trouble dans un tube d’ED stérile
- Ensemencer une galerie API 20E
- Incuber la galerie 24h à 37°C
Si oxydase (+) :
- Préparer une suspension trouble dans un tube de sérum
physiologique (SP)
- Ensemencer les tests de NO3 à PNPG d’une galerie API 20NE
- Ensemencer une ampoule AUX avec 10 gouttes (200µL) de
suspension préalablement préparée en sérum physiologique
- Ensemencer la suite de la galerie API 20NE correspondant à
l’auxanogramme (tests GLU à PAC)
- Incuber la galerie 24h à 37°C
3) Tests métaboliques et culturaux
A partir de la suspension réalisée en ED ou en SP, ensemencer :
- une gélose trypticase soja (TS) : gélose non sélective
- une gélose Drigalski : gélose sélective (cristal violet et sels biliaires) et différentielle : (lactose et
indicateur coloré de pH, le bleu de bromothymol). Si fermentation du lactose, virage de
l’indicateur coloré au jaune (acidification) colonies jaunes = lactose (+) ; colonies bleues ou
vertes = lactose (-)
- une gélose au cétrimide (ammonium quaternaire)
- un milieu viande-foie (VF) qui permet la détermination du type respiratoire : aérobie stricte,
microaérophile, aéro-anaérobie facultative, anaérobie stricte
- Incuber 24h à 37°C
4) Après incubation
- Pour les galeries API 20E et API 20NE : ajouter les réactifs (cf tableau de lecture), lire la galerie et
interpréter à l’aide du catalogue analytique correspondant
- Interpréter les milieux de culture
Pour ensemencer la galerie :
- test non souligné : remplir le
tube
- test souligné : remplir le tube et
ajouter de l’huile de paraffine
pour créer une anaérobiose
- test encadré : remplir le tube et
la cupule
tube
cupule

3 – Identification des cocci à Gram positif (le cas échéant)
1) Test d’orientation : recherche de la catalase (enzyme de la chaine respiratoire bactérienne)
Sur une lame de verre, déposer :
- une goutte d’H2O2 à 10 volumes (avec une pipette et un cône jaune)
- une goutte de culture (bouillon) (avec une pipette et un cône jaune)
- une lamelle
Observer la formation de bulles d’O2 :
- présence de bulles : Catalase (+) = Staphylocoques, microcoques
- absence de bulles : catalase (-) = Streptocoques, entérocoques
2) Tests culturaux
A partir de la culture fournie en bouillon, ensemencer :
- une gélose trypticase soja (TS)
- une gélose Chapman (sélectivité liée à la forte concentration en NaCl et différentielle par la
présence d’un sucre (mannitol) et d’un indicateur de pH (rouge de phénol)).
Virage au jaune (acidification) = fermentation du mannitol = mannitol (+)
Pas de virage coloré = pas de fermentation du mannitol = mannitol (-)
- un milieu viande foie (VF) qui permet la détermination du type respiratoire : aérobie
stricte, microaérophile, aéro-anaérobie facultative, anaérobie stricte
- une gélose au sang qui permet la culture de bactéries exigeantes, sur laquelle placer un
disque de bacitracine et un disque d’optochine
Incuber 24h à 37°C
3) Pour les cocci Gram (+) catalase (+)
- A partir du bouillon de culture, ensemencer une gélose à ADN en stries radiales pour rechercher la
désoxyribonucléase (DNase) et l’incuber à 37°C pendant 24h.
- Rechercher la coagulase :
- ajouter 200µL de bouillon dans 200µL de plasma de lapin
- placer au bain marie à 37°C pendant 2 heures au minimum
- retourner le tube pour vérifier si un coagulum s’est formé
4) Pour les cocci Gram (+) catalase (-)
Ensemencer une gélose BEA (Bile – Esculine – Azide) et l’incuber 24h à 37°C

5) Après incubation
Interpréter les milieux de culture :
- sur gélose au sang, présence d’une hémolyse α (hémolyse partielle) ou β (hémolyse totale),
inhibition autour des disques d’optochine (seul Streptococcus pneumoniae est sensible à
l’optochine) et bacitracine (la grande majorité des streptocoques de groupe A est sensible à
la bacitracine)
- sur gélose BEA, noircissement du milieu lié à l’hydrolyse de l’esculine (entérocoques)
- sur gélose à ADN, ajouter de l’HCl (1N) pour révéler la présence d’une DNase (si présence de
l’enzyme, clarification autour des stries)
Pour les cocci Gram(-), catalase (-) et β-hémolytiques, réaliser le test de sérogroupage de Lancefield
(test d’agglutination avec des particules de latex sensibilisées avec des Ac dirigés vers les Ag
de groupe).
Schéma récapitulatif
1
/
4
100%