ASCO-GI 2009

Coordonnateur :
David Malka (Institut Gustave-Roussy, Villejuif)
Auteurs :
David Malka (Institut Gustave-Roussy, Villejuif)
Julien Taïeb (hôpital Européen Georges-Pompidou, Paris)
Emmanuel Mitry (hôpital Ambroise-Paré, Boulogne)
Gérard Lledo (hôpital Privé Jean-Mermoz, Lyon)

La Lettre du Cancérologue
Sommaire
1. Cancers digestifs non colorectaux
1.Cancers œsogastriques
2.Carcinome hépatocellulaire
3.Cancers biliaires
4.Cancer du pancréas
5.Tumeurs endocrines
6.Tumeurs de l’intestin grêle
2. Cancer colorectal

La Lettre du Cancérologue
1. Cancers digestifs non
colorectaux

La Lettre du Cancérologue
1.1 Cancers œsogastriques

La Lettre du Cancérologue
Cancers œsogastriques
Polymorphisme EGF A61G (variant G/G) :
•risque d’ADK de l’œsophage x 2
•taux d’EGF plus élevés au cours du RGO
309 patients avec ADK de l’œsophage et 275 sujets sains
Polymorphisme du gène de l’EGF, reflux gastro-œsophagien (RGO) et
risque d’adénocarcinome (ADK) de l’œsophage (1/2)
* Ajustées en fonction de l’âge, du sexe, du statut tabagique, du nombre de paquets-années et de l’IMC.
Cas/témoins
Analyses ajustées*
A/G vs A/A G/G vs A/A
OR (IC95) p OR (IC95) p
Cohorte totale 309/275 1,22 (0,8-1,8) 0,30 1,90 (1,2-3,0) 0,007
RGO 150/62 3,59 (1,7-7,7) 0,001 9,71 (3,8-25) < 0,001
Pas de RGO 159/213 0,70 (0,4-1,1) 0,13 0,44 (0,2-0,9) 0,02
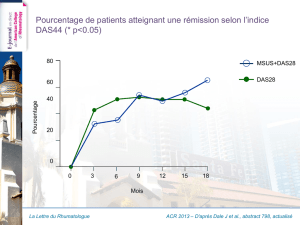
Population globale : augmentation du risque chez les G/G (OR = 1,90)
Dans la population avec RGO, le génotype G/G est associé à un OR de 9,71
1
ASCO GI 2009 - D’après Cheung WY et al., abstract 2 actualisé
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
1
/
75
100%