Alcools - Eduscol

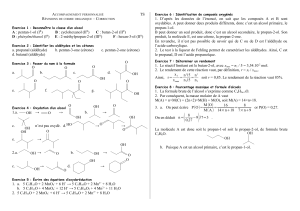
Réactifs Conditions Produits Nom Remarques Mécanisme
ALCOOLS-ROH
R-OH H+,130°C R-O-R éther déshydratation
intermoléculaire en concurrence avec la
déshydratation intramoléculaire 2 R-OH → R-O-R + H2O
H+180°C >C=C< alcène déshydratation
intramoléculaire Ζ E1 non stéréospécifique
Ζ Saytzeff CH-C-OH CH-C + + H2O
H+
H+ + C=C
NH3350°C,20 bars
cat :Al2O3 ou ThO2
RNH2 ;RNHR
RRRN méthode de
Sabatier
S.N
réalisée en phase gazeuse, il n’y a
pas d’ammonium quaternaire NH3 + ROH → RNH2 + H2O
RNH2 + ROH → RNHR + H2O
RNHR + ROH → RRRN + H2O
H-X solvant : eau dérivé halogéné
R-X S.N Ζ réactivité : HI>HBr>HCl
Ζ pour HCl emploi de
ZnCl2(cat) (test de Lucas)
Ζ C(III)>C(II)>C(I)
R-O-H + H+ R-OH2X-R-X + H2O
+
PCl5
SOCl2
éther ou
pyridine dérivé chloré
R-Cl R-OH + PCl5 → R-Cl + O=PCl3 + HCl
R-OH + SOCl2 → R-Cl + SO2 + HCl
PBr3solvant : anhydride
éthanoïque dérivé bromé
R-Br 3 R-OH + PBr3 → 3 R-Br + H3PO3
R’-COOH H+,∆ester
R’-COOR estérification Ζ équilibre déplacé par
distillation de l’ester ou
élimination d’eau ;
Ζ alcool(III)→ élimination ;
Ζ athermique : ∆rH°=0
pour alcools Ire et Iire
R'-C + H+
O
OH R'-C OH
OH
+
R-OH R'-C-OH
OH
OH
R+
R'-C-OH2
+
OH
O
R
ester
- H2O
-H+
R-C O
Cl ou
R-C
O
OC
O
-R
dans la
pyridine
R-COOR
(+ HCl ou
R-COOH)
estérification Ζ réaction rapide et totale
Ζ la pyridine fixe l’acide libéré
et catalyse la réaction R-C O
Cl R'-O-H+ R-C-Cl
O
OH
R' +
-
H + Cl
+-+ester

>C=O H+
-C-OR
OR acétal
Acétalisation
A.N Ζ protection de la fonction
carbonyle
Ζ équilibre déplacé par
élimination d’eau par
hétéroazéotrope avec le
toluène
Ζ pour la cétone on utilise un
diol
C=O + H +C-O-H
+ROH C-O-H
O-H
R+
H + C-O-H
+
OR
hémiacétal
H+
-H2O C
OR
+ROH C-O-H
OR
R++H +-C-OR
OR
∆cat : Cu
500°C >=O cétone ou
aldéhyde déshydrogénation arrêt à l’aldéhyde s’il n’y a pas
de dioxygène R-CH2OH R-CHO
CHOH CO
R
R'
R
R'
CrO3 + pyridine
ou
CrO3Cl- pyrH+
solvant : CH2Cl2>=O cétone ou
aldéhyde réactif de Sarett
PCC
Ζ ces réactifs n’oxydent pas
l’aldéhyde en acide ;
Ζ idem avec MnO2 ou Ag2CO3
sur Ar-CH2OH et
R-CH=CH-CH2OH
R-CH2OH R-CHO
CHOH CO
R
R'
R
R'
Cr2O72-,H2SO4 (1)
CrO3,H2SO4 (2)
ClO-, MnO4-
solvant eau ou
acétone (2) cétone ou acide Ζ (1) mélange
sulfochromique
Ζ (2) réactif de
Jones
l’aldéhyde s’oxyde en acide R-CH2OH R-C O
HR-C O
OH
DIOLS
H2SO4cétone ou aldéhyde trasposition
pinacolique
(Tiffeneau)
Ζ étape 1 :il se forme le
carbocation le plus stable
Ζ étape 2 :aptitude migratrice :
Ar-D>Ar-H>Ar-A>H>R
C-C
HO OH
R
- H2O
H
+C-C
R
OH
+C-C
R
OH
+
H + -C-C R
O
+

HIO4 ou
Pb(CH3COO)2
solv : eau
solv : organique cétones ou
aldéhydes oxydation avec
coupure C=C l’aldéhyde ne s’oxyde pas en
acide avec HIO4:
C C + HIO4
OH OH
CC
OIO
OH
OO
HIO3 + C=O + O=C
EPOXYDES
∆ ou
cat : Ag+, Mg2+ cétone ou aldéhyde isomérisation peut se produire avec un
organomagnésien C C-H
O
R
R
H
CH-C-H
R
RO
A-H+milieu acide CA-C-OH addition
électrophile
en anti
AH :
Ζ H2O, ROH, CH3COOH, HCN
C CH2
O+ H +C CH2
O
H
R
RR
R
+
''
ROH
- H
+CC
R
R' OH
H
H
R-O
cas de ROH
A-B+milieu basique puis
hydrolyse acide -C-C-A
OH
addition
nucléophile
en anti
A-B+ :
Ζ RONa, KCN, NH3, RMgX
C C
O
H2
RR'
+ A-C-C
RR' A
HH
O-
puis H
+C-C
RR'
HO H
H
A

Diisocyanate
Exemple :
CH3
N
N
C O
C
Opolyurethane
Phosgène + diamine→
diisocyanate
Utilisations:
Mousse pour matelas, peintures,
coque chaussures à ski, piste
d’athlétisme…
Bilan :
n O=C=N-(CH2)6-N=C=O + n HO-(CH2)2-OH
[-O-(CH2)2-O-C-NH-(CH2)6-NH-C-]n
OO
Diester
ou
diacide polyester
P.E.T : polytéréphtalate
d’éthylène glycol
Utilisations: fibre, bouteille pour
boissons gazeuses, film…
Bilan :
n+ n HO-(CH2)2-OH
CC OCH3
O
O
H3C
O
2 n CH3OH + CC OCH2-CH2-]n
O
O
O
[-
1
/
4
100%