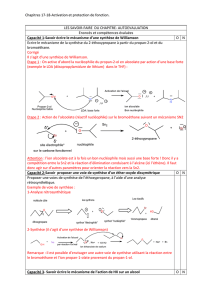
Document

Chapitre 4
Mécanismes Réactionnels

Table des Matières
108
Introduction & Motivation
1. Le carbone comme base de la chimie organique
2. La nature de la liaison covalente
2.1. Orbitales atomiques et hybridation
2.2. Formation des liaisons simples
2.3. Formation des liaisons multiples
2.4. Délocalisation d’électrons, aromaticité, structures de résonance
3. La structure moléculaire
3.1. Règles de base de la nomenclature
3.2. Isomères
4. Mécanismes réactionnels
4.1. Thermodynamique et cinétique des réactions
4.2. Substitutions nucléophiles
4.3. Substitutions nucléophiles sur les carbonyles
4.4. Additions électrophiles sur liaisons multiples
4.5. Substitutions électrophiles sur les composés aromatiques
4.6. Réactions d’élimination
4.7. Réactions radicalaires
5. Quelques classes de composés organiques
1 h
1 h
8 h
2 h
1 h
1 h
4 h
4 h
2 h
2 h
8 h
1 h
3 h
1 h
1 h
1 h
1 h
6 h

4.1
Thermodynamique, Cinétique et Classication des Réactions
“Chimie Organique” de Paul Arnaud: chapitre 5, pp 105-114

Mécanismes réactionnels
Bilan et Mécanisme Réactionnel
110
acide alcool eau
bilan réactionnel
mécanisme réactionnel
réactifs produits
étape élémentaire
catalyseur
•le bilan réactionnel décrit les réactifs et les produits d´une réaction
•le mécanisme réactionnel décrit les étapes élémentaires de la réaction
•le catalyseur joue un rôle dans la réaction mais il ne change pas après la réaction
R
O
OH
+HO R' R
O
O
+
R'
H2O
H
R
OH
OH
H
HO R'
R
OH
OH
O
H
R'
R
O
OH
O
R'
H
H
R
O
OH
R'
+H
–
H
~
+ H2O
–
ester

Thermodynamique des Réactions Chimiques (1)
111
R
O
OH
+HO R' R
O
O
+
R'
H2O
¢GR=¢G
R+RT ln [R–COOR’][H2O]
[R–COOH][R’–OH]
¢GR>0
¢GR<0
¢GR=0
réaction exergonique, a lieu de gauche à droite
réaction endergonique, a lieu de droite à gauche
réaction en équilibre
•l´enthalpie libre de réaction ΔGR détermine le sens de la réaction
•l´enthalpie libre standard de réaction ΔG°R correspond à des conditions standards (1 bar, 25°C, tous les
réactifs à 1 mol/L)
•la thermodynamique dépend des énergies mises en jeu lors des réactions chimiques
Mécanismes réactionnels
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
1
/
74
100%