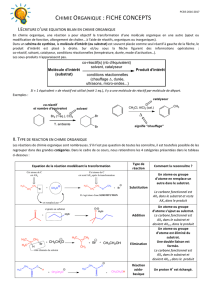
chimie organique : fiche concepts

! ! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!"#$%&'#!()*+,()*-!
./0102!345670892!:!;0./2!.37.2<=>! !
0? 2.40=942!@A972!2896=037!B0"67!27!./0102!345670892!
2C!DEFGF#!H'IJCFKL#M!LC#!'NJDOFHC!J!PHL'!HQR#DOF$!SJ!O'JCT$H'GJOFHC!UALC#!GHSNDLS#!H'IJCFKL#!#C!LC#!JLO'#?!!
Le#bilan#est#donc#parfois#écrit#en#ne#faisant#apparaître#avant#et#après#la#flèche#que#les#molécules#organiques.##
"#T!JLO'#T!'NJDOF$T!P#L&#CO!VO'#!FCUFKLN!TL'!SJ!$S%DE#?!"#T!JLO'#T!P'HULFOT!P#L&#CO!JPPJ'JWO'#!TL'!HL!THLT!SJ!$S%DE#M!P'NDNUN!UALC!
TFIC#!,!?!0ST!P#L&#CO!GVG#!C#!PJT!JPPJ'JWO'#!UL!OHLO?!!
"#!THS&JCOM!S#T!DJOJSXT#L'T!N&#COL#ST!JFCTF!KL#!SJ!O#GPN'JOL'#M!S#T!P'HPH'OFHCT!HL!S#!O#GPT!U#!'NJDOFHC!P#L&#CO!VO'#!FCUFKLN!TL'!
HL!THLT!SJ!$S%DE#?!!
!
Exemple':''
!
!
>HL&#COM! LC#! 'NJDOFHC! $JFO! FCO#'&#CF'! LC#! GHSNDLS#! H'IJCFKL#! KL#! SAHC! GHUF$F#! YJRHLO! U#! $HCDOFHCM! GHUF$FDJOFHC! U#! $HCDOFHCM!
JSSHCI#G#CO!U#!DEJWC#Z[!\!SAJFU#!U#!'NJDOF$TM!H'IJCFKL#T!HL!FCH'IJCFKL#T?!"J!GHSNDLS#!H'IJCFKL#!U#!UNPJ'O!P#LO!VO'#!JPP#SN#!
substrat?!
!00?!426.=0]0=2!27!./0102!345670892!
"#! GHO#L'! U#T! 'NJDOFHCT! #C! DEFGF#! H'IJCFKL#! YEH'GFT! S#T! 'NJDOFHCT! 'JUFDJSJF'#T[! #TO! SJ! '#CDHCO'#! #CO'#! LC! électrophile!#O! LC!
nucléophile!:!!
3C!JPP#SS#!électrophile!Y^!KLF!JFG#!S#T!NS#DO'HCT!_[!LC#!#TP%D#!DEFGFKL#!DJPJQS#!UAJDD#PO#'!LC!UHLQS#O!UANS#DO'HC!PHL'!$H'G#'!
LC#!SFJFTHC!J&#D!LC!JLO'#!'NJDOF$!YKLF!#TO!$H'DNG#CO!CLDSNHPEFS#[?!2`!:!!!/a!
3C!JPP#SS#!nucléophile!Y^!KLF!JFG#!S#T!CHXJL`!_[!LC#!#TP%D#!DEFGFKL#!DJPJQS#!U#!UHCC#'!LC!UHLQS#O!UANS#DO'HC!PHL'!$H'G#'!
LC#!SFJFTHC!J&#D!LC!JLO'#!'NJDOF$!YKLF!#TO!$H'DNG#CO!NS#DO'HPEFS#[?!2`!:!/3,!
'
Remarque':'La'notion'de'nucléophilie/électrophilie'est'une'notion'cinétique':"bon"nucléophile"=>"réaction"rapide.'
Les'réactions'du'cours'de'CPGE'sont'en'général'sous'contrôle'cinétique':'on's’intéressera'donc'à'la'nucléophilie'ou'à'l’électrophilie'des'réactifs.'
!
<J'!#`O#CTFHCM!HC!PJ'S#!U#!^!TFO#!électrophile!_!YbHC#!UN$FDFOJF'#!#C!NS#DO'HCT!TL'!LC!'NJDOF$!KLF!&J!UHCD!JOOF'#'!LC!UHLQS#O[M!#O!U#!
^!site#nucléophile!_!YbHC#!'FDE#!#C!NS#DO'HCT!TL'!LC!'NJDOF$!KLF!&J!UHCD!DNU#'!LC!UHLQS#O[?!
Exemple':''
'
'
Effets#électroniques#(notion#très#importante)#
• 9C!substituant#électro>attracteur!&J!appauvrir!S#!DJ'QHC#!#C!U#CTFON!NS#DO'HCFKL#!UHCD!S#!'#CU'#!électrophile?!!
0S!#`FTO#!U#L`!OXP#T!UA#$$#OT!NS#DO'H,JOO'JDO#L'!:!
Effet#inductif#attracteur#(>#I)#
"AJOHG#!U#!DJ'QHC#!#TO!SFN!\! LC! JOHG#!O'%T! NS#DO'HCNIJOF$?!0S!
PH'O#!UHCD!SA#`D%T!U#!DEJ'I#!PHTFOF&#!ca?!.#OO#!#$$#O!TAJOONCL#!
J&#D!SJ!UFTOJCD#?!
!
Effet#mésomère#attracteur#(>#M)#
9C! TLQTOFOLJCO! #TO! DJPJQS#! UdJOOF'#'! #O! U#! PH'O#'! LC! UHLQS#O!
CHC! SFJCO! #O! JFCTF! UFGFCL#'! SJ! U#CTFON! NS#DO'HCFKL#! TL'! S#T!
JLO'#T!JOHG#T?!
!
!
• 9C!TLQTOFOLJCO!électro>donneur!&J!enrichir#S#!DJ'QHC#!#C!U#CTFON!NS#DO'HCFKL#!UHCD!S#!'#CU'#!nucléophile?!!
0S!#`FTO#!U#L`!OXP#T!UA#$$#OT!NS#DO'H,UHCC#L'!:!
Effet#inductif#donneur#(+#I)#
"AJOHG#! U#! DJ'QHC#! #TO! SFN! \! LC! JOHG#! GHFCT! NS#DO'HCNIJOF$!
KL#!SLF?!0S!PH'O#!UHCD!SA#`D%T!U#!DEJ'I#!CNIJOF&#!ce?!
Y#`#GPS#!UJCT!S#T!H'IJCHGJICNTF#CT!4,1I,f[?!
!
Effet#mésomère#donneur#(+#M)#
9C! TLQTOFOLJCO! PH'O#L'! UdLC!UHLQS#O! CHC! SFJCO! P#LO!S#! DNU#'!
PHL'!'#C$H'D#'!SJ!U#CTFON!NS#DO'HCFKL#!TL'!S#T!JLO'#T!JOHG#T?!
!
!
Remarque':'quand'le'groupement'a'deux'effets'antagonistes,'c’est'en'général'l’effet'mésomère'qui'l’emporte'sur'l’effet'inductif.'
O
_
O
_
_
_
_
site électrophile
C Mg Cl
_
_
_
H
H
C
H
H
Hχ(C) > χ(Mg)
δ+
δ−
site nucléophile
O
_
O
_
_
_
site nucléophile
4NJDOF$!FCH'IJCFKL#!
>HS&JCO!
<'HULFO!P'FCDFPJS!LCFKL#G#CO?!"#!QFSJC!U#!
SJ!'NJDOFHC!CA#TO!PJT!NKLFSFQ'N!FDF?!!

! ! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!"#$%&'#!()*+,()*-!
Repérer#les#sites#électrophiles#et#nucléophiles#
! 2C!HQT#'&JCO!SJ!U#CTFON!NS#DO'HCFKL#!:!!
,! @HLQS#O! CHC! SFJCO! HL! SFJFTHC! GLSOFPS#! g! TFO#!
PHO#COF#SS#G#CO!CLDSNHPEFS#!!
,!"JDLC#!NS#DO'HCFKL#!g!TFO#!NS#DO'HPEFS#!
! 2C!NOLUFJCO!SJ!PHSJ'FTJOFHC!U#T!SFJFTHCT!:!!
, ca!:!TFO#!NS#DO'HPEFS#!h!!
, c,!:!TFO#!CLDSNHPEFS#!
! 2C! ND'F&JCO! U#T! $H'GLS#T! GNTHG%'#T!
PHL'!$JF'#!JPPJ'JWO'#!U#T!UHLQS#OT!CHC,
SFJCOT!HL!U#T!SJDLC#T!NS#DO'HCFKL#T!
!
!!
!
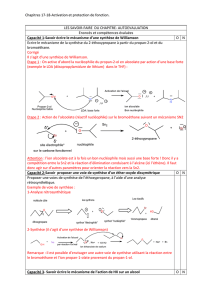
000?!>2"2.=0]0=2!
1. Régiosélectivité#
9C#! 'NJDOFHC! #TO! UFO#! régiosélective!TFM! PHL&JCO! UHCC#'! U#L`! YHL! PSLTF#L'T[! FTHG%'#T! U#! DHCTOFOLOFHCM! #SS#! #C! UHCC#! LC! YHL!
D#'OJFCT[!GJRH'FOJF'#G#CO?!!
Exemple':' '
2. Stéréosélectivité#
9C#! 'NJDOFHC! #TO! UFO#! stéréosélective!TFM! PHL&JCO! UHCC#'! PSLTF#L'T! TON'NHFTHG%'#T! U#! DHC$FIL'JOFHCM! #SS#! #C! UHCC#! D#'OJFCT!
GJRH'FOJF'#G#CO!Y&HF'#!#`DSLTF&#G#CO[?!
Exemple':''
!
!
3C!P#LO!P'NDFT#'!:!! !
• >F! HC! P#LO! HQO#CF'! PSLTF#L'T! UFJTON'NHFTHG%'#T! #O! D#'OJFCT! THCO!HQO#CLT! GJRH'FOJF'#G#COM! SJ! 'NJDOFHC! #TO! UFO##
diastéréosélective?!
• >F! HC! P#LO! HQO#CF'! PSLTF#L'T! NCJCOFHG%'#T! #O! D#'OJFCT! THCO! HQO#CLT! GJRH'FOJF'#G#COM! SJ! 'NJDOFHC! #TO! UFO##
énantiosélective!YPSLT!'J'#!DJ'!PSLT!UF$$FDFS#!i[?!
Remarque':'pour'montrer'la'stéréosélectivité'd’une'réaction,'il'faut'représenter'les'réactifs'et'les'produits'en'3D.'
'
Exemple':''
'
'
On'obtient'un'couple'd’énantiomères'et'pas'leurs'diastéréoisomères,'donc'cette'réaction'est'diastéréosélective.'
'
3. Stéréospécificité#
9C#!'NJDOFHC!#TO!UFO#!stéréospécifique#TF!SJ!DHC$FIL'JOFHC!U#T!P'HULFOT!UNP#CU!U#!D#SS#!U#T!'NJDOF$T?!!
Remarque'1' :' pour' montrer'la' stéréospécificité' d’une' réaction,' il' faut' choisir' deux' réactifs' de' configurations' différentes' et' montrer' que' les'
produits'obtenus'à'partir'de'chacun'des'deux'réactifs'sont'alors'de'configurations'différentes.'''
Remarque'2':'une'réaction'stéréospécifique'est'nécessairement'stéréosélective.'
#
Déterminer#la#sélectivité#des#réactions#suivantes#
Substitution'électrophile'aromatique':'
HNO3, H2SO4
NO2
NO2
++
NO2
40% 3% 57%
'
Substitution'nucléophile'SN2':''
Br OH
HO-
+OH
100% 0%
'
'
Remarque":"Doit8on"représenter"les"molécules"en"3D"lorsque"l’on"écrit"un"mécanisme"?"
Tout'dépend'de'ce'que'l’on'veut'montrer':''
• Si' la' réaction' dont' on' écrit' le' mécanisme' n’est' pas' stéréosélective,' et/ou' que' l’on' ne' cherche' pas' à' préciser' la' stéréochimie' des'
réactifs'ou'des'produits,'on'peut'représenter'le'mécanisme'en'2D.''
Attention,'cela'ne'signifie'pas'que'toutes'les'molécules'sont'planes,'mais'simplement'que'l’on'ne's’intéresse'pas'à'leur'stéréochimie'!''
• Si' la' réaction' est' stéréosélective,' et/ou' que' l’on' cherche' à' connaître' la' stéréochimie' des' produits,' il' faut' représenter' toutes' les'
molécules'en'3D.''
50% 50%
+Br Br 25 ∞C
CH3
H
Br
Br
H
C2H5CH3
H
Br
Br
H
C2H5CH3
H
Br Br
H
C2H5
CH3
H
Br Br
H
C2H5
+++
0% 0%
Ph
OH
+H
Ph
-H2O
Ph
+
ZE
5% 95%
O
_
_
NH2
_
i)
j)
H3C
H
H
1
/
2
100%