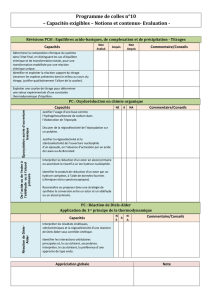
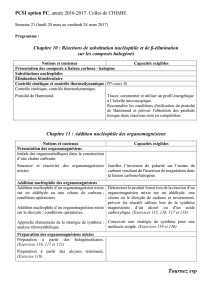
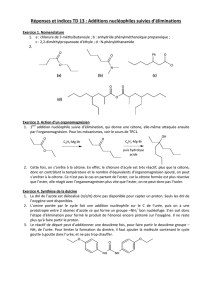
Créations de liaisons C-C. Utilisation des organomagnésiens.

: halogénures d'alkylmagnésium
Ex: CH3-Mg-I (CH3)2-CH-Mg-Cl

!"#
Equivalent d'un $.
→ base forte (pKa = 55)
→ très nucléophile.
%:
●Réaction avec l'eau
●Réaction avec un alcyne terminal (pKa = 25)

"##
$&
'
#$&
La réaction permet la formation d'un .
Mécanisme: cf tableau
Stéréochimie: réaction #.

!'
La réaction permet la formation d'un ou
d'un #$&.
'(!().
Pas de régiosélectivité spécifique avec un
organomagnésien.

"#
&
"&
&
La réaction permet la formation d'un .
Mécanisme: cf tableau
 6
6
 7
7
 8
8
 9
9
1
/
9
100%