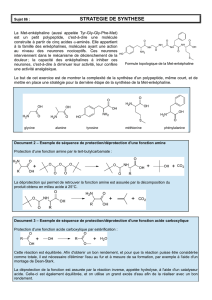
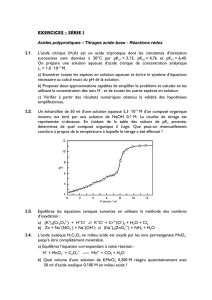
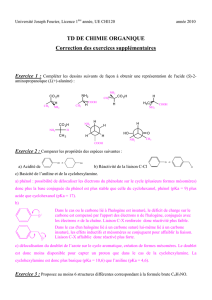
Acide α-aminés

Acide α-aminés
Voici la représentation de 2 acides aminés :
CH2
CH C
O
OHNH2
CH2
CH3
CH2CH2C
O
OHCH2
CH2
NH2
1. Entourer et nommer les groupes caractéristiques des molécules.
Groupe amino : - NH2 Groupe carboxyle : - COOH
2. Les acides α-aminés jouent un rôle fondamental en biochimie comme constituants élémentaires des
protéines : ils polymérisent en formant des liaisons peptidiques qui aboutissent à de longues chaînes
macromoléculaires appelées peptides.
Lequel de ces deux acides correspond à un acide α-aminé ?
Le premier est un acide α-aminé : le groupe amino est sur me carbone α, 1er carbone après COOH
3. L’alanine est un des 22 acides aminés codés génétiquement. Sa chaine est constituée de 3 carbones.
Donner la formule semi-développée de l’alanine.
CH C
O
OHNH2
CH3
O
OHNH2
4. L’alanine possède 2 pKa : pKa1=2,33 et pKa2=9,71 à 25 °C.
Comment expliquer cette propriété ?
Le groupe amino – NH2 confère à la molécule une identité de base.
Le groupe – COOH confère à la molécule une identité d’acide.
A chacun de ces groupes correspond un couple acido-basique de pKa différent.
5. Le pKa d’un couple acide carboxylique/ion carboxylate est en général compris entre 2 et 5 ; le pKa’
d’un couple ion ammonium/amine est en général compris entre 9 et 10.
Compléter le diagramme suivant, en donnant sur un même axe les domaines de prédominance des
espèces suivantes : R-COOH, R-COO- ; R’-NH3+ ; R’-NH2.
R-COOH / R-COO-
R- COOH
R – COO-
R’-NH3+ / R’-NH2
R’ – NH3+
R – NH2
pKa
pKa’
pH
0
14

6. Donner le diagramme de prédominance de l’Alanine. En déduire les couples acido-basiques de
l’alanine.
O
OHNH3+
O
O-
NH3+
O
O-
NH2
Charge globale
+ 1
0
-1
7. Indiquer sous chacune des formes de l’alanine sa charge globale.
Remarque : on appelle zwitterion l’ion neutre.
8. L’alanine est créée dans les cellules musculaires dont le pH est 7. Sous quelle forme l’alanine est
obtenue ?
L’alanine est obtenu sous la forme de son zwitterion (forme neutre) :
O
O-
NH3+
9. La lysine est un acide α-aminé dont la formule semi-développée est la suivante :
O
OH
NH2
NH2
Cette molécule possède 3 pKa : pKa1 = 2,15 pKa2 = 9,16 pKa3 = 10,67
Information : le groupe amino R – NH2 est une base plus forte que le groupe α-amino.
Tracer le diagramme de prédominance de la lysine. Indiquer la charge globale de chacune des
formes.
OOH
NH3
+
NH3+
OO-
NH3
+
NH3+
OO-
NH2
NH3+
OO-
NH2
NH2
Charge globale
+ 2
+ 1
0
-1
10. On cherche à séparer un mélange d’alanine et de lysine. On utilise pour cela une technique appelée
électrophorèse, basée sur la migration différentielle de molécules ionisées, déposées sur un support
soumis à une différence de potentiel.
pKa1
pKa3
0
14
pKa2
pKa1
pKa2
pH
0
14

Pour cela, on dépose sur une bandelette de papier imprégnée d’une solution aqueuse de pH = 6, une
goutte d’un échantillon contenant le mélange.. La bandelette de papier est connectée à un
générateur de tension constante qui la soumet à une différence de potentiel :
Résultat :
Justifier le résultat obtenu.
La tension imposée aux bords de la feuille imbibée a pour effet de créer un champ électrique
E
orienté
de la cathode vers l’anode du générateur. En présence de ce champ, seule une particule globalement
chargée (q) se met en mouvement sous l’action de la force
EqF
Or à pH = 6, l’alanine est majoritairement sous forme de son zwitterion neutre, alors que la lysine est
sous forme d’un ion chargé +1. Seule la lysine sera soumise à une force électrique orientée dans le
même sens que le champ électrique.
La lysine se déplace vers l’anode (borne – du générateur), alors que l’alanine ne bouge pas.
−
+
E
F
Lysine
Alanine
−
+

Exercice n°4 P354
a. Les groupes carboxyle CO2H et amine NH2 ont des propriétés acido-basiques.
b. Le pKa du couple -CO2H/-CO2 vaut 2,3 ; celui du couple –NH3+/-NH2 vaut 9,7.
c. On trace les domaines de prédominance de l’acide et de la base de chaque couple puis on combine les
deux diagrammes :
d. D’après le diagramme, à pH = 7,5, l’espèce prédominante est :
Exercice n°29 P361
Voici les modifications à prendre en compte et qui ont été modifiées dans la deuxième version du manuel
élève :
- la « valine » remplace partout dans l’exercice la « proline » ;
- pKa1 = 2,3 et pKa2 = 9,6.
1. a.
b. Dans l’intervalle [0 ; 2,3], le groupe carboxyle est neutre et le groupe amino possède une charge +I.
L’acide aminé possède donc une charge globale +I.
Dans l’intervalle [2,3 ; 9,6], le groupe carboxyle possède une charge -I et le groupe amino possède une
charge +I. L’acide aminé possède donc une charge globale –I + I = 0.
Dans l’intervalle [9,6 ; 14], le groupe carboxyle possède une charge -I et le groupe amino est neutre.
L’acide aminé possède donc une charge globale -I.
2. a.

b. Sur le diagramme ci-dessous on a remplacé les différentes formes par leur charge. Sur la dernière ligne
on fait la somme des charges pour déterminer la charge globale de l’acide aspartique pour chacun des 4
intervalles de pH déterminés :
c. À un pH égal à 7,0 par exemple, la valine est neutre et l’acide aspartique présente une charge –I.
Exercice n°30 P 361
Voici la modification à prendre en compte et qui a été modifiée dans la deuxième version du manuel
élève : la « valine » remplace la « proline ».
Sur le papier, les espèces chargées positivement seront attirées par la borne – du générateur, les
espèces chargées négativement par la borne + et les espèces neutres ne migreront pas. D’après
l’exercice 29, à un pH égal à 6, l’acide aspartique possède une charge –I et la valine est neutre. On
observera donc la migration de l’acide aspartique vers la borne + et une absence de migration de la
valine.
1
/
5
100%