faculté de médecine henri warembourg importance de l`observance

UNIVERSITÉ DU DROIT ET DE LA SANTÉ - LILLE 2
FACULTÉ DE MÉDECINE HENRI WAREMBOURG
Année : 2014
T H È S E P O U R L E D I P L Ô M E D ' É T AT
D E D O C T E U R E N M É D E C I N E
IMPORTANCE DE L'OBSERVANCE THERAPEUTIQUE DANS LES MALADIES
CHRONIQUES. ETUDE ORIGINALE CONDUITE DANS LA
SPONDYLARTHRITE ANKYLOSANTE
Présentée et soutenue publiquement le 7 juillet 2014 à 16 heures
au Pôle Recherche
Par Agathe Tonnel
_______________
JURY
Président :
Monsieur le Professeur René-Marc FLIPO
Assesseurs :
Monsieur le Professeur Bernard CORTET
Monsieur le Professeur Raymond GLANTENET
Monsieur le Docteur Alex NOËL
Directeur de Thèse :
Monsieur le Professeur René-Marc FLIPO
Travail du Service de Rhumatologie du CHRU de Lille
_______________

Table des matières
Avertissement :................................................................................................................................ 7
Tableaux et figures :.........................................................................................................................8
Listes des abréviations :...................................................................................................................9
1.INTRODUCTION ..........................................................................................................................10
2.GENERALITES.............................................................................................................................. 12
2.1 Les définitions..........................................................................................................................12
2.1.1 L'observance thérapeutique..............................................................................................12
2.1.2 L'adhésion thérapeutique..................................................................................................13
2.1.3 L'alliance thérapeutique................................................................................................... 13
2.1.4 La non-observance thérapeutique.................................................................................... 14
2.1.5 Le principe d'autonomie des patients............................................................................... 15
2.1.6 L' « empowerment ».........................................................................................................15
2.2 Les mesures de l'observance thérapeutique............................................................................. 16
2.2.1 Les méthodes directes...................................................................................................... 17
2.2.2 Les méthodes indirectes................................................................................................... 17
2.3 La problématique de l'observance thérapeutique dans les maladies chroniques ....................19
2.3.1 Les déterminants de l'observance thérapeutique..............................................................19
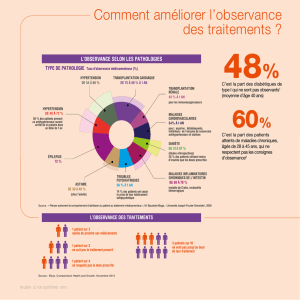
2.3.2 Quelques chiffres sur l'observance thérapeutique dans les maladies chroniques ...........21
2.4 La spondylarthrite ankylosante (SA)....................................................................................... 23
2.4.1 Les caractéristiques de la spondylarthrite ankylosante ................................................... 23
2.4.2 La prise en charge thérapeutique :................................................................................... 25
2.4.2.1 La prise en charge non-pharmacologique :.............................................................. 25
2.4.2.2 La prise en charge pharmacologique :......................................................................26
2.4.2.2.1 Le traitement symptomatique :......................................................................... 26
2.4.2.2.2 Le traitement de fond :......................................................................................26
2.5 L'observance médicamenteuse en rhumatologie......................................................................30
2.5.1 Les méthodes d'évaluation de l'observance en rhumatologie...........................................30
2.5.1.1 Morisky Medication-Taking Adherence Scale (MMAS).........................................30
2.5.1.2 Medication Adherence Report Scale (MARS)......................................................... 30
2.5.1.3 Compliance Questionnaire on Rheumatology (CQR)..............................................31
2.5.2 Résultats de l'observance médicamenteuse dans la polyarthrite rhumatoïde...................31
2.5.3 Résultats de l'observance médicamenteuse dans la spondylarthrite ankylosante............33
3.L'ETUDE :.......................................................................................................................................34
3.1.Objectif :.................................................................................................................................. 34
3.2.Matériel et méthode :............................................................................................................... 34
3.2.1 Critères d'inclusion :.........................................................................................................34
3.2.2 Recueil de données :........................................................................................................ 34
3.2.2.1 Auto-questionnaire :................................................................................................. 34
3.2.3 Niveaux d'observance médicamenteuse utilisés :............................................................ 35
3.2.4 Analyse statistique :......................................................................................................... 35
3.3.Résultats...................................................................................................................................35
3.3.1 Description de la population ........................................................................................... 35
3.3.2 Description de la thérapeutique........................................................................................36
3.3.3 Observance médicamenteuse .......................................................................................... 36
4.DISCUSSION..................................................................................................................................39
4.1 Résultats de l'étude :................................................................................................................ 39
4.2 Limites de l'étude.....................................................................................................................41
4.3 Perspectives de l'étude ........................................................................................................... 41
5

5.CONCLUSION............................................................................................................................... 47
6.ANNEXES...................................................................................................................................... 48
7.BIBLIOGRAPHIE.......................................................................................................................... 65
6

Avertissement :
« .+$&#!#!#))"##!+.+#!55"8("#+1"5(#("#'&0('!')#'$!'
3'!'*.!$$!'-.('"#5"5!'9$!+'+!+'»
7

Tableaux et figures :
-Tableau 1 : Les DMARDs........................................................................................................... 27
-Tableau 2 et 3 : La biothérapie,les antiTNFalpha...........................................................................29
-Tableau 4 : Evaluation de l'observance médicamenteuse de patients atteints de Polyarthrite
Rhumatoïde en fonction du traitement et des méthodes d'évaluation utilisés..................................32
-Tableau 5 : Les niveaux d'observance en fonction du score aux 2 questionnaires CQR et MG.... 35
-Tableau 6 : Données descriptives de la population........................................................................ 35
-Tableau 7 : Répartition des traitements de fond dans la cohorte (n= 54 patients)..........................36
-Diagramme 1 : Taux d'observance (%) en fonction du type de traitement de fond....................... 38
8
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
1
/
68
100%