Chapitre sur les piles et l`oxydo-réduction - Physique

Ce qu’il faut savoir pour le devoir du jeudi 15 mai
Chapitre sur les piles et l'oxydo-réduction
Définitions d'oxydant ; de réducteur ; d'oxydation ; de réduction
NB : on dit parfois que l'oxydant et le réducteur d'un même couple Ox/Red sont conjugués.
Être capable d'écrire la demi-équation d'oxydo-réduction d'un couple Ox/Red (dite aussi demi-équation
électronique)
Ox + n e- = Red
Stratégie :
o Commencer par équilibrer les éléments chimiques
on équilibre d'abord les éléments chimiques autres que O et H
on équilibre ensuite les O en ajoutant, si besoin des molécules d'H2O
on équilibre ensuite l'élément H en ajoutant des ions H+
o On équilibre enfin la charge électrique en ajoutant des électrons e-.
Être capable d'écrire l'équation de réaction d'une équation d'oxydo-réduction entre l'oxydant Ox 1 d'un couple
Ox 1 / Red 1 et le réducteur Red 2 d'un autre couple Ox 2 /Red 2
Stratégie :
o On écrit d'abord les deux demi-équations d'oxydo-réduction pour chacun des couples
o L'équation de réaction est une combinaison linéaire de ces deux demi-équations. On s'arrange pour que le
nombre d'électrons captés par les oxydants Ox 1 soit le même que le nombre d'e- cédés par les réducteurs
Red 2.
Savoir qu'une pile convertit de l'énergie chimique en énergie électrique = convertisseur électrochimique
Savoir qu'une pile est constituée de :
o 2 demi-piles :
Une demi-pile contient l'oxydant et le réducteur d'un couple Ox/red
Une demi-pile comporte une électrode à la surface de laquelle se produit la réaction Redox
(+ comme généralement, l'un des composés est une espèce ionique en solution, une demi-pile
comporte solution dite "électrolytique" ou "électrolyte".)
o un pont salin qui permet de fermer le circuit lorsque la pile fonctionne. Le pont salin fait la jonction entre
les deux demi-piles.
Ex :
Savoir que le sens conventionnel du courant dans un circuit va du pôle + du générateur (ou de la pile) vers le pôle -.
Savoir que les électrons vont dans le sens inverse au sens conventionnel de circulation du courant (les e- sont
chargés négativement : ils vont donc vers le pôle +)
Être capable de retrouver la polarité d'une pile connaissant les réactions qui se produisent aux électrodes et vice-
versa
Savoir brancher correctement un ampèremètre pour qu'il affiche une intensité positive (borne com côté pôle -)
Savoir que la conduction du courant à l'intérieur des solutions électrolytiques des demi-piles et à l'intérieur du pont
salin est assuré par les ions.
Chapitre sur les molécules organiques oxygénées
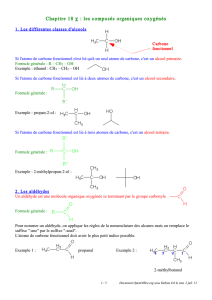
Être capable de reconnaître et de nommer :
un alcool
(gr. caractéristique : hydroxyle)
un aldéhyde
(gr. caractéristique : carbonyle)
un acide carboxylique
(fr. caractéristique : carboxyle)
une cétone
(gr. caractéristique : carbonyle)
Propriétés des acides carboxyliques :
o Savoir qu'un acide carboxylique est un acide, c'est à dire qu'il peut céder un H+ lors d'une réaction
acide/base
o Savoir que la base conjuguée d'un acide carboxylique est appelée ion carboxylate
pile

o Savoir qu'un acide carboxylique peut réagir avec l'eau dans une réaction acide/base avec le couple
H3O+/H2O :
R - COOH + H2O = R-COO- + H3O+
Par conséquent, la dissolution d'un acide carboxylique dans l'eau donnera une solution acide (pH < 7)
(concentration d'ions H3O+ plus importante que dans l'eau pure)
o Savoir qu'un acide carboxylique peut former des liaisons hydrogènes avec l'eau et être capable d'expliquer
ce qu'est une liaison hydrogène.
o Savoir que plus la chaîne carbonée d'un acide carboxylique est longue (partie apolaire de la molécule), plus
sa solubilité dans l'eau diminue.
o Savoir que plus le pH d'une solution aqueuse augmente, plus la solubilité de l'acide carboxylique dans cette
solution augmente.
Tests caractéristiques :
o Savoir que la DNPH permet de détecter la présence d'un groupement carbonyle (précipité jaune).
o Savoir que la liqueur de Fehling permet de détecter un aldéhyde (précipité rouge brique lorsqu'on chauffe).
Être capable de déterminer la classe d'un alcool
Connaître le résultat de l'oxydation des différents types d'alcools :
Classe de l'alcool
Résultat de l'oxydation ménagée si l'oxydant est en
Défaut
Excès
I
Aldéhyde
Acide carboxylique
II
Cétone
Cétone
III
Pas d'oxydation
Pas d'oxydation
Savoir que l'oxydation d'un aldéhyde donne un acide carboxylique
Être capable de retrouver les demi-équations d'oxydo-réduction suivantes (Ne pas les apprendre par cœur !) pour
ensuite trouver l'équation d'oxydation d'une molécule oxygénée.
Couple aldéhyde / alcool primaire :
Couple cétone / alcool secondaire :
Couple acide carboxylique / aldéhyde :
TP sur le tracé de caractéristiques de différents dipôles
o Connaître tout ce qui figure dans la feuille de rappel de collège sur l'électricité
(Vous n'aurez que des questions basiques sur cette partie).
Rédaction de la copie
- Encadrez les résultats
- Pour les calculs, pensez à :
1. Donner le calcul littéral (la formule avec les lettres)
2. Faire l’application numérique en vérifiant les unités des différents termes
3. Donner le résultat avec son unité et le bon nombre de chiffres significatifs
- Faites des phrases pour répondre aux questions qu’on vous pose
ion carboxylate
1
/
2
100%