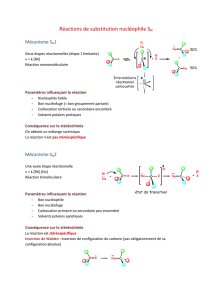
Correction Sujet Bonus 1 de Chimie Organique populaire

CORRECRTION DU SUJET BONUS DU
22.10.11
1) Réponse : ADE
A. Vrai
B. Faux, le carbocation qui possède le plus d’effet inductif donneur stabilisant venant des
groupements alkyles est le carbocation tertiaire (car c’est celui qui a le plus de radicaux
stabilisants)
C. Faux
D. Vrai ! On obtient un seul énantiomère à la fin de la réaction
E. Vrai. Tout-à-fait, ça peut arriver et ça s’appelle une induction asymétrique (par exemple en
cas de liaisons hydrogènes intramoléculaires ou d’encombrement stérique qui stabilisent un
énantiomère par rapport à un autre)
2) Réponse : BC
La difficulté était de voir qu’il s’agit d’une SN1 (2 étapes) intramoléculaire, avec nucléophile et
nucléofuge sur la même molécule :
NH2
CH3
O-
O
N
H2CH3+O
NH2
CH3+Br-
50% 50%
+
Br-+
Br
NH2
CH3
O-
Départ du nucléofuge et
formation du carbocation
tertiaire
Attaque équiprobable de
l'oxygène sur les deux faces
du plan du carbocation. Pas
de stéréosélectivité, ni
d'induction asymétrique
Remember :
Nucléophile, espèce attirée par les sites pauvres en électrons, et qui attaque et se lie à un
atome des ces sites
Nucléofuge : espèce qui est détachée d’une molécule lors d’une substitution ou d’une
élimination
Ces deux termes ne sont pas symétriques ! Nucléofuge n’est pas une caractéristique thermo-
dynamique…
L’atome O attaque le carbone lié au brome et se lie ensuite à ce carbone avec départ d’un
bromure, donc O est le nucléophile et Br est le nucléofuge
E) Faux, pas d’eau en produit, donc pas de déshydratation
3) Réponse : BE

A. Attaque sur les deux faces donc pas de stéréosélectivité. La stéréosélectivité intervient
dans le cas d’encombrement stérique trop important et donc d’attaque sur la face la plus
accessible. Or, les deux faces du carbocation sont accessibles
B. Vrai
C. Faux, ce n’est pas possible, on ne trouve jamais de carbocation tertiaire ayant une
bipyramide trigonale comme intermédiaire. L’encombrement stérique serait trop
énorme. Imaginez Michelin qui se replie sur lui-même, ça ferait un peu mal…
D. Faux, il y a deux étapes, dont la première cinétiquement déterminante
E. Vrai, c’est une SN1 intramoléculaire
4) Réponse : ABE
+
I
OH NH2
CH3
OH NH2
CH3
+I-
+
OH NH2
CH3
+-OH
NH2
CH3
O
OH
NH2
CH3
O
O
+
Forme majoritaire obtenue à
cause de la liaison hydrogène
formée entre la fonction
hydroxyle et la fonction amine ; il
y a induction asymétrique
A. Vrai, souvenez-vous que le carbanion est stabilisé par un effet mésomère accepteur venant
de l’oxygène divalent (lié par double liaison). Ici notez bien que la mésomérie se déplace sur
deux liaisons
B. Vrai, I est un excellent nucléofuge (=groupe partant), bien meilleur que OH-
C. Faux, cf B
D. Faux, on ne retrouve pas les deux énantiomères dans les mêmes proportions. En fait il n’y
pas d’attaque équiprobable, car l’attaque d’une face est favorisée par la liaison hydrogène
entre le groupe hydroxyle et le groupe amine. On peut donc dire qu’il y a induction
asymétrique.
E. Vrai, cf D
5) Réponse : ABD
A. Vrai le carbone porteur du méthyle et du tertio-butyle et celui porteur du méthyle et de
l’iode, ce sont deux carbones asymétriques.
B. Vrai, l’halogène est ici l’iode.

C. Faux, Attention ici il fallait comprendre qu’on allait avoir une substitution nucléophile certes,
et que l’ordre serait de 1 et non de 2. Et oui ici on est face à un halogène tertiaire, avec un
gène stérique important qui empêche la formation de l’intermédiaire réactionnel d’une SN2
(bipyramide). Ici ce qui va se passer c’est qu’on va former un carbocation tertiaire, donc
relativement stable, qui sera ensuite attaqué par l’alcoolate
D. Vrai.
E. Faux, Et non… Un carbocation tertiaire attention !
6) Réponse : ABE
Mécanisme réactionnel :
La première étape est la formation d’un carbocation stabilisé donc par effet 3 effets inductif. C’est
l’étape déterminante de la réaction c'est-à-dire dont la cinétique dirige la réaction, l’étape la plus
longue autrement dit encore. C’est la raison pour laquelle on est dans une réaction d’ordre 1, ici
une SN1, car cette UNIQUE étape dirige la réaction => D’où l’expression de la vitesse : v =
k[MoléculeA] où k est un constante.
La deuxième étape est l’attaque de l’alcoolate, espèce nucléophile comme dit dans l’énoncé.
Il ne faut pas oublier qu’un carbocation c’est plan, ici l’attaque peut se faire des deux côtés, on forme
donc deux carbones asymétriques de configuration différentes. La molécule ayant déjà un centre
asymétrique, on va former deux molécules en relation de diastéréoisomérie !
Gros piège cependant, le groupement tertio-butyle de la molécule A entraîne une gène stérique, ce
qui a tendance à diriger l’attaque de l’alcoolate de façon à former majoritairement C1 par rapport à
C2.
7) Réponse : BD
Voir plus haut !

1
/
4
100%