PROGRAMME DE COLLE n°1

PROGRAMME DE COLLE n°17.
Semaine du 20/02 au 24/02/17
C-Mécanismes en chimie organique
0-Généralités.
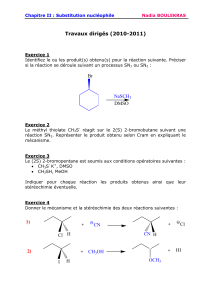
I-Substitutions nucléophiles.
Les halogénoalcanes, un exemple de substrats : nomenclature, liaison polarisée et polarisable, réactivité : rupture
hétérolytique de la liaison C-X, influence de la nature de X, X- groupe partant ou nucléofuge, électrophilie du C :
substitution nucléophile SN, acidité en : -élimination E.
Bilans, conditions opératoires et exemples : formation de produits variés (alcools, éthers, esters, nitrile, amines…),
observations expérimentales.
SN2 : mécanisme et cinétique, stéréochimie, influence des facteurs sur la vitesse (substrat (X, R), nucléophile,
solvant (cas du nucléophile anionique)).
SN1 : mécanisme et cinétique, stéréochimie, influence des facteurs sur la vitesse donc sur v1 car (1) est
cinétiquement déterminante : substrat, postulat de Hammond, rôle de la stabilité du carbocation, aucune
influence du nucléophile, solvant, réarrangement ou transposition du carbocation.
Compétition SN1 / SN2 : mécanismes limites, idéaux, influence de la chaine carbonée, du nucléophile
(concentration et force du nucléophile) et du solvant.
II--Eliminations.
régiosélectivité (règle de Saitsev) et diastéréosélectivité (si le mécanisme permet la formation des deux
diastéréoisomères : E > Z).
mécanisme limite E2 : mécanisme, cinétique et stéréochimie : conformation anti pour le H en et le
nucléofuge, réaction totalement diastéréosélective et stéréospécifique s’il n’y a qu’un seul H en , c’est-à-dire
dans le cas où Ca et C sont asymétriques, influence des facteurs sur la vitesse (substrat (X, R (faible influence
de la classe par rapport à la SN2)), base (exemples classés), solvant (cas de la base chargée)).
un autre mécanisme plus rare sur les RX : E1, présenté sur le bromure de tertiobutyle dans le méthanol en
compétition avec la SN1, mécanisme, facteurs identiques à la SN1.
Compétition E/SN
III-AN des organomagnésiens mixtes sur C=O.
Les organomagnésiens mixtes : formule, nomenclature, structure (polarité, nucléophilie et basicité).
Les substrats : aldéhydes et cétones, CO2.
Addition nucléophile : formation d’alcool primaire, secondaire, tertiaire et d’acide carboxylique.
Préparation des organomagnésiens mixtes : bilan et conditions opératoires, schéma du montage, réactions
secondaires à éviter (avec H2O, réaction de Wurtz, avec O2), préparation des magnésiens acétyléniques.
Action des organomagnésiens sur les époxydes : SN2, régiosélectivité et stéréosélectivité.
IV-Analyse rétrosynthétique.
Synthons, déconnexion, équivalents synthétiques.
Exemples à partir de SN ou d’AN de RMgX : alcools, acide carboxyliques.
REVISIONS : Nomenclature, solvants, stéréochimie, spectroscopies + Lewis VSEPR.
4- Transformations chimiques en solution aqueuse.
A-Réactions d’oxydoréduction.
Oxydants et réducteurs : définitions, exemples à connaître (couple, demi-équation) : permanganate, dichromate,
hypochlorite, peroxyde d’hydrogène, thiosulfate.
1
/
1
100%