Nucléophile

Définitions et conventions :
Liaison : mise en commun de 2 éléctrons (..)
Equilibre (processus réversible)
Mésomérie (délocallisation d'électrons)
Déplacement d'un électron
Déplacement de deux électrons
Nucléophile = Nu- : centre riche en électrons (anionique ou neutre) : réaction avec un centre
pauvre en électrons (électrophile)
Electrophile = E+ : centre pauvre en électrons (cationic ou neutre) : réaction avec un centre riche
en électrons (nucléophile)
Acide/Base :
Brönsted-Lowry :
Acide = donneur de H+
Base = accepteur de H+
Lewis :
Acide = possède une lacune électronique (pauvre en
électron)
Base = possède un doublet (riche en électron)
Ordre de grandeur de longueur
d'une liaison : Å = 10-10 m
Å = Angström)
nm = nanomètre (1 nm = 10-9 m)
Ordre de grandeur de l'énergie d'une
liaison : 100 Kcal/mol ou 100x4.18
Kj/mol
Transformation non réversible
Remarque I : un nucléophile est souvent
également une base. Cependant, en
modulant l'entourage du centre riche en
électrons (en créant de l'encombrement
stérique) on peut obtenir un centre fortement
basique mais faiblement nucléophile.
Remarque II : le proton (H+) est un acide
de Lewis par excellence, il possède une
orbitale s vide.
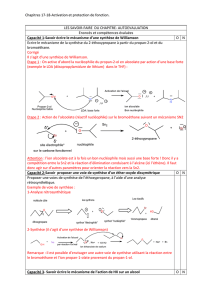
Résume de Cours de Chimie Organique (Prof. M. W. Hosseini)
Notions acquises

Du danger de la représentation simplifiée
Pour simplifier l'écriture, les chimistes utilisent une représentation simplifiée:
un trait entre deux atomes A et B ( A____B) représente la jonction entre ces
deux atomes (2 électrons = 1 liaison covalente).
*Quand il s'agit d'atomes de carbone et d'hydrogène, ils ne sont pas indiqués.
Donc pour cette représentation, il y a des implicites (par convention).
Souvent, comme on ne représente pas tous les atomes, si l'on ne prend pas
garde, on ne respecte pas la règle de l'octet (8 électrons autour du carbone,
azote, oxygène etc...) et de ce fait, sans le savoir, on "écrit des carbones
"pentavalents".
D'autre part, cette représentation ne tient pas compte de la place (volume)
occupée par les atomes, donc elle ne permet pas d'apprécier la notion de
remplissage de l'espace (encombrement stérique).
Enfin, comme il s'agit d'une projection dans un plan, on ne représente pas
l'emplacement des atomes dans l'espace (stéréochimie).
Conseil: tout en utilisant une écriture simplifiée, il faut représenter la structure
de Lewis complète des centres (souvent il s'agit d'hétéroatomes).

Exemple
OH
1
2
3
isopropanol (Propan-2-ol)
CH3
C
H3COH
C
C
CO
H
H
H
H
H
H
H
H
OH
Structure de Lewis complète pour
l'oxygène montrant que le groupe
hydroxyl est:
-un acide (donneur de H+)
-une base de Lewis et de Brönstedt
-un nucléophile
La dinemycine A (un antibiotique)
Illustration

Effets Inductifs et Mésomères :
Inductif : lié à la polarisation de liaison (moment dipôlaire : entité vectorielle donc
directionnelle résultant de la différence d'électronégativité entre deux atomes formant la
liaison), portée faible.
Mésomère : lié à la conjuguaison (recouvrement latérale d'orbitales p), effet à longue portée, en
terme d'énergie plus forte que l'effet inductif.
Solvant* : liquide (gamme de température) non réactif (doit être compatible avec la réaction
envisagée) capable de dissoudre (solvater) un composé (soluté). Il est caractérisé par sa constante
diélectrique (ε), sa température d'ébulition : Téb(passage à l'état gaz) et congélation
(solidification), sa viscosité ainsi que par son mode d'interaction avec le soluté : Solvants :
protique ou aprotique.
Solvant aprotique (ne possède pas d'hydrogènes polarisés ou "acide"), peut être faiblement (ε
faible) ou fortement polaire (εélevée): incapable de donner de liaisons Hydrogène. Exemples:
alkanes (peu polaires), Dimethylsulfoxide (DMSO), N,N-diméthyleformamide (DMF), éthers
tous polaires.
Solvant protique (protonique, possède au moins un hydrogène polarisé ou "acide"),
habituellement est polaire (ε élevée) : capable de former des liaisons hydrogène. Exemples : H2O,
R-OH.
* Compléter la liste.

H
H
HX
OH-
H
H
HO H
X-
H
H H
XHO
Ea
ΔG<0
Réactifs
Etat initial
Produits
Etat initial
Coordonnées de la réaction
Energie Etat de transition
Barrière
d'énergie Ea
ΔG<0
Coordonnées de la réaction
Energie
Complexe activé
Réaction bimoléculaire
Exemple: hydrolyse de dérivés halogénés primaires
Ea1
ΔG<0
Réactifs
Etat initial
Produits
Etat initial
Coordonnées de la réaction
Energie
Etats de transition
Barrière
d'énergie 1
Ea2
Intermédiaire
1
2
Barrière
d'énergie 2
Etape 1 Etape 2
Réaction monomoléculaire
Ea1
Coordonnées de la réaction
Energie
Ea2
Intermédiaire
carbocationique
ΔG
Exemple: hydrolyse de dérivés halogénés tertiaires
A
B
CX
OH-
A
B
COH
A
B
C
HO
+
A
B C
X
Complexe activé
A
B C
A
B C
OH
A
B C
HO
ou
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%