Colle 20

PCSI option PC, année 2016-2017. Colles de CHIMIE
Semaine 20 (lundi 13 mars au vendredi 17 mars 2017)
Programme :
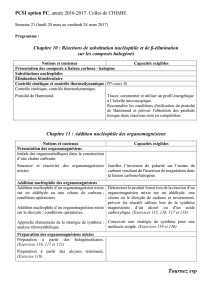
Chapitre 10 : Réactions de substitution nucléophile et de β-élimination
sur les composés halogénés
Notions et contenus Capacités exigibles
Présentation des composés à liaison carbone - halogène
Classe des halogénoalcanes
Polarisabilité d’une liaison
Exploiter les notions de polarité et de polarisabilité
pour analyser ou comparer la réactivité de
différents substrats. (Exercice 106)
Substitutions nucléophiles
Electrophile / nucléophile
Mécanisme limite SN2 : propriétés cinétiques et
stéréochimiques (Exercice 103).
Mécanisme limite SN1: propriétés cinétiques et
stéréochimiques. (Exercice 104)
Réaction stéréosélective
Réaction stéréospécifique
Identifier les sites électrophiles et/ou nucléophiles
d’une entité chimique.
Utiliser le formalisme des flèches courbes pour
décrire un mécanisme en chimie organique.
Tracer, commenter et utiliser un profil énergétique
à l’échelle microscopique.
Prévoir ou analyser la stéréosélectivité et la
stéréospécificité éventuelles d’une transformation
simple en chimie organique (substitution
nucléophile) en utilisant un vocabulaire précis.
(Exercice 105)
Justifier le choix d’un mécanisme limite SN1 ou
SN2 par des facteurs structuraux des substrats ou
par des informations stéréochimiques sur le
produit. (Exercices 104 et 106)
Élimination bimoléculaire
Mécanisme E2 : propriétés cinétiques et
stéréochimiques.
Régiosélectivité
Prévoir ou analyser la régiosélectivité, la
stéréosélectivité et la stéréospécificité éventuelles
d’une -élimination E2 en utilisant un vocabulaire
précis. (Exercices 107, 108, 109, 110, 111, 112,
113, 114)
Contrôle cinétique et contrôle thermodynamique
(TP-cours 9)
Contrôle cinétique, contrôle thermodynamique.
Postulat de Hammond.
Tracer, commenter et utiliser un profil énergétique
à l’échelle microscopique.
Reconnaître les conditions d'utilisation du postulat
de Hammond et prévoir l'obtention des produits
lorsque deux réactions sont en compétition.
Tournez svp

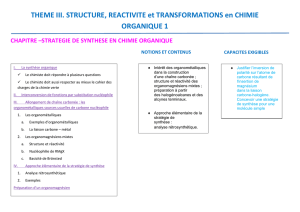
Chapitre 11 : Addition nucléophile des organomagnésiens
Notions et contenus Capacités exigibles
Présentation des organomagnésiens
Intérêt des organométalliques dans la construction
d’une chaîne carbonée
Structure et réactivité des organomagnésiens
mixtes
Justifier l’inversion de polarité sur l’atome de
carbone résultant de l'insertion de magnésium dans
la liaison carbone-halogène.
Addition nucléophile des organomagnésiens
Addition nucléophile d’un organomagnésien mixte
sur un aldéhyde ou une cétone de carbone ;
conditions opératoires.
Addition nucléophile d’un organomagnésien mixte
sur le dioxyde ; conditions opératoires.
Approche élémentaire de la stratégie de synthèse :
analyse rétrosynthétique.
Déterminer le produit formé lors de la réaction d’un
organomagnésien mixte sur un aldéhyde, une
cétone ou le dioxyde de carbone et inversement,
prévoir les réactifs utilisés lors de la synthèse
magnésienne d’un alcool ou d’un acide
carboxylique. (Exercices 115, 116, 117 et 118)
Concevoir une stratégie de synthèse pour une
molécule simple. (Exercices 119 et 120)
Préparation des organomagnésiens mixtes
Préparation à partir des halogénoalcanes.
(Exercices 116, 117 et 121)
Préparation à partir des alcynes terminaux.
(Exercice 118)
1
/
2
100%