chapCO2_redoxenchimi..

!"
!"#$#%&'()*+#,-%&
"
!"*.#/(%&!0&1&2!34&5&
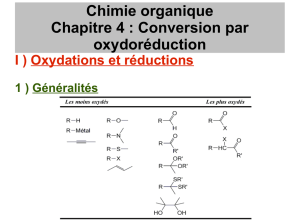
0678'3(98-:/#'+&%+&:"#$#%&'()*+#,-%"
"
"
"
"
Cours de chimie de seconde période de PCSI
"
"
"
"
"
"
"
"

#"
"
$%&'()*+,)-"$%"
!
Réactions*d’oxydo"
réduction*en*chimie&
organique!!
"

."
"
"
/0"$12-"34"5)467"

8"
"
"
;3&<0=>?@&AB0CDAEF;0<&AG&!E?>0<@&@<&!H;=;@&0?IE<;JG@& K"
4L&<0=>?@&AB0CDAEF;0<&A@&!&@F&<0=>?@&AB0CDAEF;0<&=0D@<& K"
ML&0CDAEF;0<&@F&?@AG!F;0<&@<&!H;=;@&0?IE<;JG@& N"
OL&@!?;FG?@&A@P&A@=;3@JGEF;0<P3@Q@!F?0<;JG@P& N"
;;&0CDAEF;0<&A@P&EQ!00QP& R"
4L&Q@P&F?0;P&!QEPP@P&ABEQ!00QP&@F&Q@&2?0AG;F&A@&Q@G?&0CDAEF;0<& R"
ML&0CDAEF;0<&!0<F?0Q@@&A@P&EQ!00QP&2?;=E;?@P&@<&EQA@HDA@P& S"
OL&0CDAEF;0<&A@P&EQ!00QP&P@!0<AE;?@P&@<&!@F0<@P&44"
KL&0CDAEF;0<&!H;=;0P@Q@!F;T@&44"
;;;&0CDAEF;0<&A@P&EQ!@<@PU&PE<P&0G&ET@!&!Q;TEI@&4M"
4L&2EPPEI@&EG&A;0Q&VT;!;<EQW&5&0CDAEF;0<&PE<P&!Q;TEI@&4M"
!9!9":'/;<"=">?"/@;/%?<?";A">'B/"C'%'<;/";C?%"B&B8"!#"
!9#9"?D?E$/?&"=" !."
!9.9"&F?G?B&?/?%F'C'F?"?F"&F?G?B&$?%'H'%'F?">?"/;"G?;%F'B<"!."
!989"B&B8"="%;F;/I&?AG">?"/;"G?;%F'B<"?<"$G?&?<%?">@A<"%B(%;F;/I&?AG"!8"
ML&2EPPEI@&EGC&!0=20P@P&!E?>0<DQ@P&5&!0G2G?@&0CDAE<F@&A@P&A;0QP&2E?&Q@P&;0<P&2@?;0AEF@&4X"
OL&2EPPEI@&A@&QBEQ!@<@&EGC&!0=20P@P&!E?>0<DQ@P&5&!0G2G?@&0CDAE<F@&@<&2?@P@<!@&A@&0P0K&V!EFW&
@F&AB;0<P&2@?;0AEF@&4N"
.9!9":'/;<"J?<?G;/">?"/@BDI>;F'B<">?"/?E'?AD(KBL<&B<"M!NOPQ"!P"
.9#9"?D?E$/?&"!R"
;T&?@AG!F;0<P&A@P&EQA@HDA@P&@F&!@F0<@P&@<&EQ!00QP&4S"
4L&>;QE<&I@<@?EQ&4S"
ML&?@AG!F;0<&2E?&<E>HKU&?@AG!F@G?&!H;=;0P@Q@!F;Y&A@P&EQA@HDA@P&@F&!@F0<@P&MZ"
#9!9":'/;<"J?<?G;/"#S"
#9#9"&%L?E;"G?;%F'B<<?/"#S"
#9.9"&F?G?B&?/?%F'C'F?"BA"<B<"T" #!"
OL&EGF?@P&HDA?G?@P&GF;Q;P@P&MM"
"
I"#Nombre#d’oxydation#du#carbone#en#chimie#organique##
"
"
4L&<'$[(%&8B'678*/#'+&8%&!&%/&+'$[(%&8B'678*/#'+&$'7%+&
"
?-"5U,V,0")6W2-,X40Y"1@Z1ZV0-+"50-+621"07+"10"526[)-09"
/2"5)-\,W462+,)-"Z105+6)-,X40"\)-32V0-+210"30"1@2+)V0"30"526[)-0"07+"="4\M&M\M&M.M9"
"
$)77Z32-+" 8" Z105+6)-7" 30" ]210-50Y" ,1" *04+" 107" 5Z306" \)6V0110V0-+" +)47" 107" 8"=" 10" 30W6Z"
3@)^_32+,)-"30"1@Z1ZV0-+"526[)-0"07+"32-7"50"527"]&;T9"
%)V*1Z+2-+" 72" 5)45U0" 0^+06-0" 2]05" 8" Z105+6)-7" 2\,-" 3@25X4Z6,6" 12" 5)-\,W462+,)-"
,7)Z105+6)-,X40"34"-Z)-"M#7##*PQY"10"-)V[60"3@)^_32+,)-"30"1@Z1ZV0-+"526[)-0"07+"3)-5"
32-7"50"527"^&;T9"

O"
"
%)-5147,)-"="10"-)V[60"3@)^_32+,)-"30"1@Z1ZV0-+"526[)-0"]26,0"30"^;T"`"]&;T9"
"
&
Q%&:*(['+%&&&
""""""">4"VZ+U2-0"%L8""a"
-9)M%Q"b"3&;T"
"""""""""""""""""""""""""a";4"3,)^_30"30"526[)-0"%B#"
-9)M%Q"b"]&;T"
"
Ainsi%:%%
"
>2-7" 107" V)1Z54107" )6W2-,X407Y" 10" 30W6Z" 3@)^_32+,)-" *04+" *60-360" 307" ]210467"
3,\\Z60-+07"307"304^"*6Z5Z30-+079"
"
>2-7"107"V)1Z54107")6W2-,X407Y"107"2+)V07"30"526[)-0"7)-+"1,Z7"7)4]0-+"`"307"2+)V07"
3@)^_Wc-0"="
"
• %@07+"10"527"32-7"107"*_:''_\&?O!30H&
• %@07+"10"527"32-7"10")('-.%&:*(['+7_%&8%\&*_89"78%\&?!H0&%/&:9/'+%\&?M!`0&
• %@07+"10"527"32-7"107"*:#8%\&:*(['67_#,-%\&?3!V`0W0H&
"
'1" 07+" 3)-5" \6ZX40-+" 30" 60-5)-+606" 1@2+)V0" 30" 526[)-0" 32-7" 307" 30W6Z7" 3@)^_32+,)-"
3,\\Z60-+79"
%,+)-7"X401X407"0^0V*107"="
"
"
"
<)47"60+,0-36)-7"107"]210467"74,]2-+07"="
"
)('-.%&
A%)(9&8B'678*/#'+&8%&_B9_9$%+/&:*(['+%&
!HO&3!&
("'''"
!3!HM3!&
("''"
!`!HM&
("''"
!≡!3H&
("'"
?O!30H&
d"'"
?!H0&
d"'"
?!00H&
d"'''"
"
OH OH
O
OH
O
OH
O
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%